
| A. | 11.2g | B. | 8.4g | C. | 16.8g | D. | 22.4g |
分析 发生反应为:Fe+2HCl═FeCl2+H2↑①、Fe+H2SO4═FeSO4+H2↑②,加入铁粉质量相等,如果对于这两个反应都是铁不足,则Fe完全反应,生成气体体积之比为1:1,若酸都不足,则酸完全反应,根据方程式可知,生成的气体体积之比为1:2,而实际气体体积之比为2:3,所以肯定是铁对一个反应来说是不足,对于另一个反应是过量.通过方程式可以看出来,铁消耗HCl多,对于①反应来说是盐酸不足,可以算出来生成H2物质的量,根据体积比可算出来②反应生成n(H2),对于②反应是Fe不足,以此计算铁的质量.
解答 解:发生反应为:Fe+2HCl═FeCl2+H2↑①、Fe+H2SO4═FeSO4+H2↑②,加入铁粉质量相等,
如果对于这两个反应都是铁不足,则Fe完全反应,生成气体体积之比为1:1,
若酸都不足,则酸完全反应,根据方程式可知,生成的气体体积之比为1:2,
而实际气体体积之比为1:2,所以肯定是铁对一个反应来说是不足,对于另一个反应是过量.通过方程式可以看出来,铁消耗HCl多,对于①反应来说是盐酸不足,对于②反应是Fe不足,
HCl的物质的量为0.1L×4mol/L=0.4mol,由Fe+2HCl═FeCl2+H2↑,可知生成气体的物质的量为0.4mol×$\frac{1}{2}$=0.2mol,
所以由硫酸生成的气体的物质的量为0.2mol×$\frac{3}{2}$=0.3mol,
设铁的质量为x,则:
Fe+H2SO4═FeSO4+H2↑
56g 1mol
x 0.3mol
所以,56g:x=1mol:0.3mol,解得x=16.8g,
故选C.
点评 本题考查化学方程式的计算,关键利用生成氢气的体积关系、结合反应方程式判断反应的过量问题,侧重分析与计算能力的考查,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2017届湖南省长沙市高三上学期第13次周测理科综合化学试卷 题型:实验题
硫化亚铁煅烧得到的烧渣的主要成分为FeO、Fe3O4和Fe2O3等。利用该烧渣制备铁红和副产品无氯钾肥的流程如下:
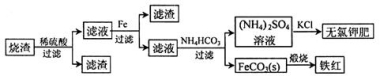
回答下列问题:
(1)煅烧硫化亚铁若生成Fe2O3和SO2,则生成标准状况下11.2L SO2气体,转移电子的物质的量为____________。
(2)该流程中加入铁粉的作用是____________(用离子方程式表示)。
(3)已知四种盐的溶解度随温度变化的曲线如图所示。请回答下列问题:
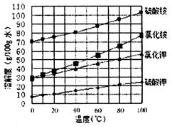
①向滤液II中加入NH4HCO3溶液所发生反应的离子方程式是________________。
②向(NH4)2SO4溶液加入KCl后得到无氯钾肥应进行的操作为_________、________、洗涤、干燥等;反应的化学方程式为_______________。
(4)用含少量硫酸亚铁和硫酸铁的硫酸铜溶液制备CuSO4·5H2O的流程如下:
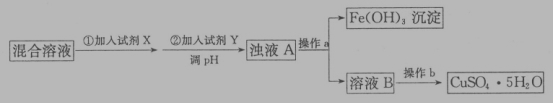
加入试剂X的目的是_____,调节溶液pH的试剂Y可能是_____(填字母编号)。
a.NaOH
b.CuO
c.NH3·H2O
d.Cu(OH)2CO3
Cu2+为0.2mol·L-1的溶液,欲除尽Fe3+(当离子浓度小于1*10-5mol·L-1时,离子已沉淀完全,)调整溶液pH的精确范围是_____(已知:Kap[Cu(OH)2]=2×10-20,Kap[Fe(OH)3]=8.0×10-38,lg2=0.3)。
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | X、Y元素能与氢形成分子式为H2XY2、H4X2Y2等弱酸 | |
| B. | 化合物ZY2中只含有离子键 | |
| C. | 工业上可用X单质置换ZY得到Z单质 | |
| D. | Y的氢化物的沸点比其下一周期的同族元素的氢化物的沸点低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3固体(NaHCO3) 加热 | B. | I2(沙子) 加热 | ||
| C. | Na2O2(Na2O) 氧气中加热 | D. | Cl2(HCl) 通过NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素R位于周期表中第ⅦA族 | |
| B. | RO3-中的R只能被还原 | |
| C. | R2在常温常压下一定是气体 | |
| D. | 若1 mol RO3-参与该反应,则转移电子的物质的量为6 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com