
【题目】某溶液中含有大量下列离子:Fe3+、SO42-、Al3+和M离子,且这四种离子Fe3+、SO42-、Al3+和M的物质的量之比为2:4:1:1,则M离子可能为下列中的( )
A.Na+B.I-C.S2-D.Cl-
科目:高中化学 来源: 题型:
【题目】实验室以正丁醇、溴化钠、硫酸为原料制备正溴丁烷的反应如下:
NaBr+H2SO4═HBr+NaHSO4
CH3CH2CH2CH2OH+HBr ![]() CH3CH2CH2CH2Br+H2O
CH3CH2CH2CH2Br+H2O
在圆底烧瓶中加入原料,充分振荡后加入几粒沸石,安装装置Ⅰ.加热至沸腾,反应约40min.待反应液冷却后,改装为装置Ⅱ,蒸出粗产品.部分物理性质列表如下: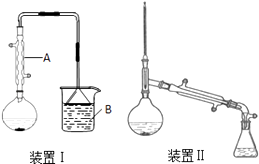
物质 | 正丁醇 | 正溴丁烷 |
沸点/℃ | 117.2 | 101.6 |
熔点/℃ | ﹣89.12 | ﹣112.4 |
密度/gcm﹣3 | 0.8098 | 1.2758 |
溶解性 | 微溶于水,溶于浓硫酸 | 不溶于水和浓硫酸 |
将所得粗产品倒入分液漏斗中,先用10mL水洗涤,除去大部分水溶性杂质,然后依次用5mL浓硫酸、10mL水、10mL饱和NaHCO3溶液、10mL水洗涤.分离出有机层,加入无水氯化钙固体,静置1h,过滤除去氯化钙,再常压蒸馏收集99~103℃馏分.
回答下列问题:
(1)仪器A的名称是 , 冷却水从A的(填“上”或“下”)口通入.
(2)在圆底烧瓶中加入的原料有:①10ml水;②7.5ml正丁醇;③10g溴化钠;④12mL浓硫酸.上述物质的加入顺序合理的是(填正确答案标号).
a.①④②③b.④①②③c.③④①②
(3)烧杯B中盛有NaOH溶液,吸收的尾气主要是(填化学式).本实验使用电热套进行加热,总共使用了次.
(4)用浓硫酸洗涤粗产品时,有机层从分液漏斗(填“上口倒出”或“下口放出”).最后一次水洗主要是洗掉
(5)制备正溴丁烷时,不直接用装置Ⅱ边反应边蒸出产物,其原因是 .
(6)本实验得到正溴丁烷6.5g,产率为(只列式,不必计算出结果).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作中选择的仪器正确的是:①分离汽油和氯化钠溶液 ②从含Fe3+的自来水中到蒸馏水③分离氯化钾和二氧化锰混合物 ④从氯化钠溶液中得到氯化钠晶体

A. ①-丁 ②-丙 ③-甲 ④-乙 B. ①-乙 ②-丙 ③-甲 ④-丁
C. ①-丁 ②-丙 ③-乙 ④-甲 D. ①-丙 ②-乙 ③-丁 ④-甲
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W四种化合物均由原子序数小于18的元素组成,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体。这四种化合物具有下列转化关系(部分反应物、产物及反应条件已略去)。请回答:
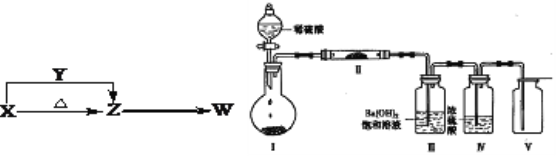
(1)W的化学式是______________。
(2)X与Y在溶液中反应的离子方程式是_________________________________。
(3)某实验小组利用上图装置(夹持固定装置已略去)进行实验,装置Ⅰ中为X,装置Ⅲ中产生白色沉淀,装置V中可收集到一种无色气体。
①装置Ⅰ中反应的化学方程式是__________________________________,装置Ⅱ中主要的化学反应方程式是__________________________________。
②Ⅱ中的物质中阳离子与阴离子个数比是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(有毒性,市场上很易与食盐混淆)是一种常见的工业用盐,广泛用于物质合成、金属表面处理等,其物理性质与NaCl极为相似.相关转化关系如图所示,下列说法不正确的是( ) 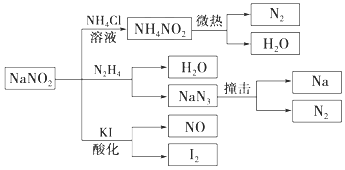
A.NaNO2在水中的溶解性大于NH4NO2
B.NaNO2与N2H4反应中,NaNO2是氧化剂
C.可用KI,淀粉和食醋鉴别NaNO2和NaCl
D.分解NaN3盐每产生1 mol N2 转移6 mol e﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】速力菲(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:
![]()
试回答下列问题:
(1)试剂1是______________,试剂2是_______________,加入新制氯水后溶液中发生的离子反应方程式是___________________________________________,_____________________________________;
(2)加入试剂2后溶液颜色由淡黄色转变为淡红色的原因可能是:_____________________。
(3)该同学猜想血红色溶液变为无色溶液的原因是溶液中的+3价铁被还原为+2价铁,你认为该同学的猜想合理吗?_______________。若你认为合理,请说明理由(若你认为不合理,该空不要作答) ;若你认为不合理请提出你的猜想并设计一个简单的实验加以验证(若你认为合理,该空不要作答)________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组微粒在指定溶液中可能大量共存的是( )
A.0.1 mol/L FeCl3溶液:K+、Br﹣、H2O2
B.含大量NO3﹣的溶液:Fe2+、SO42﹣、H+
C.水电离产生的c(OH﹣)=10﹣13mol/L的溶液:Al3+、Na+、Cl﹣
D.![]() =1×1014的溶液:NH4+、CrO42﹣、ClO﹣
=1×1014的溶液:NH4+、CrO42﹣、ClO﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com