
| 1 |
| 2 |
| (x-0.04y) |
| 0.06 |
| 1 |
| 2 |
| (x-0.04y) |
| 0.06 |
| ||
| ||
| C(CH3OH)C(H2O) |
| C(CO2)C3(H2) |
| C(CH3OH)C(H2O) |
| C(CO2)C3(H2) |
| �� �� | �� | �� |
| ��Ӧ�� Ͷ���� |
1molCO2 3molH2 |
a molCO2��b molH2�� c molCH3OH��g����c molH2O��g�� |

| 1.2g |
| 12g/mol |
| 1.68L |
| 22.4L/mol |
| 1 |
| 2 |
| 1 |
| 2 |
| 1.2g |
| 12g/mol |
| 1.68L |
| 22.4L/mol |
| 1 |
| 2 |
| 1 |
| 2 |
| (x-0.04y) |
| 0.06 |
| 1 |
| 2 |
| (x-0.04y) |
| 0.06 |
| ||
| ||
| C(CH3OH)C(H2O) |
| C(CO2)C3(H2) |
| C(CH3OH)C(H2O) |
| C(CO2)C3(H2) |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 �о�CO2�����öԴٽ���̼���Ĺ���������Ҫ�����壮
�о�CO2�����öԴٽ���̼���Ĺ���������Ҫ�����壮| c(CH3OH)c(H2O) |
| c(CO2)c3(H2) |
| c(CH3OH)c(H2O) |
| c(CO2)c3(H2) |
| �� �� | �� | �� |
| ��Ӧ��Ͷ���� | 1molCO2��3molH2 | a molCO2��b molH2�� c molCH3OH��g����c molH2O��g�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 �о�CO2�����öԴٽ���̼���Ĺ���������Ҫ�����壮
�о�CO2�����öԴٽ���̼���Ĺ���������Ҫ�����壮�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�콭��ʡ��Ǩ�и�����ѧ�ڵ�һ�������Ի�ѧ�Ծ��������棩 ���ͣ������
�о�CO2�����öԴٽ���̼���Ĺ���������Ҫ���塣
��1����CO2�뽹̿��������CO��CO�����������ȡ�
��֪��Fe2O3(s)+3C(ʯī)=2Fe(s)+3CO(g) ��H 1=+489.0 kJ��mol��1
C(ʯī)+CO2(g)=2CO(g) ��H 2=+172.5 kJ��mol��1
��CO��ԭFe2O3(s)���Ȼ�ѧ����ʽΪ ��
��2��������̼�ϳɼ״���̼���ŵ��·���CO2ת��Ϊ�״����Ȼ�ѧ����ʽΪ��
CO2(g)+3H2(g) CH3OH(g)+H2O(g)
��H
CH3OH(g)+H2O(g)
��H
�ٸ÷�Ӧ��ƽ�ⳣ������ʽΪK= ��
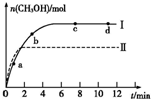
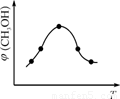
��ȡһ�����CO2��H2�Ļ������(���ʵ���֮��Ϊ1��3)����������ܱ������У�����������Ӧ����Ӧ�����в�ü״������������(CH3OH)�뷴Ӧ�¶�T�Ĺ�ϵ��ͼ��ʾ����÷�Ӧ�Ħ�H 0(�>������<������)��
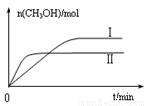
�������ֲ�ͬ�����·�����Ӧ�����CH3OH�����ʵ�����ʱ��仯��ͼ��ʾ������I�����Ӧ��ƽ�ⳣ����С��ϵΪK�� K��(�>������<������)��
��3����CO2Ϊԭ�ϻ����Ժϳɶ������ʡ�
�ٹ�ҵ������[CO(NH2)2]��CO2��NH3��һ�������ºϳɣ��䷴Ӧ����ʽΪ ������̼��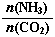 ��3����ƽ��ʱCO2��ת����Ϊ60%����NH3��ƽ��ת����Ϊ
��3����ƽ��ʱCO2��ת����Ϊ60%����NH3��ƽ��ת����Ϊ
��
����������Һ������ʽ��е�⣬CO2�ڵ缫�Ͽ�ת��Ϊ���飬�õ缫��Ӧ�ķ���ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ�꽭��ʡ������У����12���¿��Ի�ѧ�Ծ��������棩 ���ͣ������
��14�֣��о�CO2�����öԴٽ���̼���Ĺ���������Ҫ�����塣
��1����֪ʯī�ı�ȼ����Ϊy kJ��mol��1��1.2gʯī��1.68L����״����������ȼ�գ�����Ӧ��ľ����ų�x kJ��������ʯī��������Ӧ����CO���Ȼ�ѧ����ʽΪ ��
��2������ʱ����CO��ԭMgSO4���Ʊ��ߴ�MgO��
��750��ʱ����������к������ʵ���SO2��SO3����ʱ��Ӧ�Ļ�ѧ����ʽ�� ��
����MgO���Ƴɡ�þ���������Ρ�ȼ�ϵ�أ���װ��ʾ��ͼ��ͼ1���õ�ط�Ӧ�����ӷ���ʽΪ ��

 ��
�� 
ͼ1 ͼ2 ͼ3
��3��������̼�ϳɼ״���̼���ŵ��·���CO2ת��Ϊ�״����Ȼ�ѧ����ʽΪ��
CO2(g) +3H2(g)  CH3OH(g) +H2O(g) ��H
CH3OH(g) +H2O(g) ��H
�ٸ÷�Ӧ��ƽ�ⳣ������ʽΪK= ��
��ȡ��ݵ����CO2��H2�Ļ������(���ʵ���֮�Ⱦ�Ϊ1��3)���ֱ�����¶Ȳ�ͬ���ݻ���ͬ�ĺ����ܱ������У�����������Ӧ����Ӧ��ͬʱ���ü״������������(CH3OH)�뷴Ӧ�¶�T�Ĺ�ϵ������ͼ2��ʾ��������CO2ת��Ϊ�״���Ӧ�Ħ�H (�>�� ��<������)0��
�������ֲ�ͬ�����·�����Ӧ�����CH3OH�����ʵ�����ʱ��仯��ͼ3��ʾ������I�����Ӧ��ƽ�ⳣ����С��ϵΪK�� K��(�>�� ��<������)��
��һ���¶��£����ݻ���ͬ�ҹ̶��������ܱ������У������·�ʽͶ�뷴Ӧ�һ��ʱ���ﵽƽ�⡣
|
�� �� |
�� |
�� |
|
��Ӧ�� Ͷ���� |
1molCO2 3molH2 |
a molCO2��b molH2�� c molCH3OH(g)��c molH2O(g) |
������ƽ��������ѹǿΪ��ʼʱ��0.8����Ҫʹƽ������������ͬ��ֵ����������ȣ�����ʼʱά�ַ�Ӧ������У���c��ȡֵ��ΧΪ ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com