
【题目】下表为元素周期表的一部分,用化学用语回答下列问题:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
1 | ① | ||||||
2 | ② | ③ | ④ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)⑧的原子结构示意图为______________________________________________。
(2)③⑧⑩的最高价含氧酸的酸性最强的是__________(填化学式)。
(3)③的气态氢化物与③的最高价氧化物对应的水化物反应生成盐的化学方程式是_______。
(4)①④⑩三种元素的原子能形成原子数目比为1∶1∶1的共价化合物,它的电子式为_____________,②④两种元素形成原子数目比为1∶2的共价化合物的结构式为___________________________。
(5)⑤的最高价氧化物的水化物与⑦的最高价氧化物反应的离子方程式为_________,⑨的最高价氧化物的水化物的浓溶液与铜反应的化学方程式为:____________________。
【答案】![]() HClO4 NH3+HNO3==NH4NO3
HClO4 NH3+HNO3==NH4NO3 ![]() O=C=O Al2O3+ 2OH- =2AlO2- +H2O Cu + 2H2SO4(浓)
O=C=O Al2O3+ 2OH- =2AlO2- +H2O Cu + 2H2SO4(浓) ![]() CuSO4 + SO2↑+2H2O
CuSO4 + SO2↑+2H2O
【解析】
根据元素在周期表的位置,推出①为H,②为C,③为N,④为O,⑤为Na,⑥为Mg,⑦为Al,⑧为P,⑨为S,⑩为Cl,然后根据元素及其化合物的性质分析即可;
(1)⑧为位于第三周期VA族,即⑧为P,15号元素,其原子结构示意图为![]() ;
;
(2)③为N,⑧为P,⑩为Cl,目前酸性最强的含氧酸为HClO4,即③⑧⑩中最高价含氧酸的酸性最强的是HClO4;
(3)③的气态氢化物为NH3,③的最高价氧化物对应的水化物是HNO3,两者反应方程式为NH3+HNO3=NH4NO3;
(4)①为H,④为O,⑩为Cl,组成原子数目比为1:1:1的共价化合物为HClO,其电子式为![]() ;②④组成原子数目比为1:2的化合物为CO2,C和O之间共用2个电子对,即CO2的结构式为O=C=O;
;②④组成原子数目比为1:2的化合物为CO2,C和O之间共用2个电子对,即CO2的结构式为O=C=O;
(5)⑤的最高价氧化物的水化物是NaOH,⑦的最高价氧化物为Al2O3,Al2O3为两性氧化物,Al2O3+2OH-=2AlO2-+H2O;⑨的最高价氧化物的水化物是H2SO4,Cu与浓硫酸反应:Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O。
CuSO4+SO2↑+2H2O。


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:
【题目】下表是A、B、C、D四种有机物的有关信息:
A | ①能使溴的四氯化碳溶液褪色;②比例模型为 |
B | ①由C、H两种元素组成;②球棍模型为 |
C | ①由C、H、O三种元素组成;②能与Na反应,但不能与NaOH溶液反应;③能与D反应生成相对分子质量为100的酯 |
D | ①由C、H、O三种元素组成;②球棍模型为 |
回答下列问题:
(1)B具有的性质是_____(填序号)。
①无色无味液体 ②有毒 ③不溶于水 ④密度比水大 ⑤与酸性KMnO4溶液和溴水反应褪色 ⑥任何条件下不与氢气反应
写出在浓硫酸作用下,B与浓硝酸反应的化学方程式:__________
(2)只用一种试剂就能将B、C、D鉴别出来,这种试剂可以是_______
①酚酞试液 ②氢氧化钠溶液 ③碳酸钠溶液 ④水 ⑤溴水
(3)C与D反应能生成相对分子质量为100的酯,其化学方程式为:______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向圆底烧瓶中加入1 molC2H5OH和含1molHBr的氢溴酸,溶液中发生反应;C2H5OH+HBr![]() C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
A. 加入NaOH,可增大乙醇的物质的量
B. 增大HBr浓度,有利于生成C2H5Br
C. 若反应物增大至2 mol,则两种反应物平衡转化率之比不变
D. 若起始温度提高至60℃,可缩短反应达到平衡的时间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢卤酸的能量关系如图所示下列说法正确的是
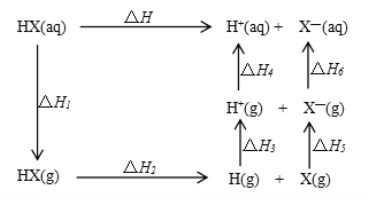
A. 已知HF气体溶于水放热,则HF的△H1<0
B. 相同条件下,HCl的△H2比HBr的小
C. 相同条件下,HCl的△H3+△H4比HI的大
D. 一定条件下,气态原子生成1molH-X键放出akJ能量,则该条件下△H2=+akJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】选择下列化学用语,用序号完成下列问题①O2②Na2O2③18O④CH3—CH2—CH2—CH2—CH3⑤O2-⑥CaCl2 ⑦O3 ⑧16O ⑨NH4Cl ⑩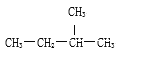
(1)只含共价键的是___________________。
(2)既含共价键又含离子键的是___________________。
(3)属于离子晶体的是______________,属于共价化合物的是_________________。
(4)互为同素异形体的是______,互为同分异构体的是______,互为同位素的是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列图示所得出的结论不正确的是

A. 图甲是CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0
CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0
B. 图乙是室温下H2O2催化分解放出氧气的反应中c(H2O2 )随反应时间变化的曲线,说明随着反应的进行H2O2分解速率逐渐减小
C. 图丙是室温下用0.1000 mol·L1NaOH溶液滴定20.00 mL 0.1000 mol·L1某一元酸HX的滴定曲线,说明HX是一元强酸
D. 图丁是室温下用Na2SO4除去溶液中Ba2+达到沉淀溶解平衡时,溶液中c(Ba2+ )与c(SO42)的关系曲线,说明溶液中c(SO42 )越大c(Ba2+ )越小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家成功合成了新型抗肿瘤铂(Ⅳ)类化合物Pt( HPxSC)Cl3,请回答下列问题:
(1)基态磷原子价电子排布图为__________________。
(2)在元素周期表中,铂元素与铁元素同族,则铂元素位于_________。
A.s区 B.p区 C.d区 D. ds区 E.f区
(3)磷、硫、氯的第一电离能由小到大的顺序为__________________(填化学式)。
(4)与S同族的相邻元素氢化物沸点最高的为_________(填化学式),其原因为_________ 。
(5)铂(Pt)单质晶体中原子的堆积方式如图所示,由图可知,晶体铂的堆积方式为_________,一个晶胞中含有_________个铂原子,距离每个铂原子最近且等距离的铂原子有_________个。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com