
| A. | 加入足量的NaOH溶液充分振荡后,用分液漏斗分液弃除下层溶液 | |
| B. | 加入溴水,生成三溴苯酚,再过滤除去 | |
| C. | 加水,加热超过 70℃(苯酚在热水中溶解度很大),然后用分液漏斗振荡分液后,弃除下层溶液 | |
| D. | 将混合物蒸馏(甲苯沸点110℃,苯酚沸点182℃),可先蒸出甲苯 |
分析 A.甲苯和苯酚互溶,混合物中加入NaOH溶液,生成苯酚钠,苯酚钠溶于水,但苯不溶于水;
B.溴、苯酚以及三溴苯酚都能溶于苯;
C.该操作方法不易操作,温度降低后会析出苯酚,不是最佳方案;
D.通过蒸馏可以分离二者,但是操作方法较复杂.
解答 解:A.加氢氧化钠溶液,苯酚和氢氧化钠反应生成溶于水的苯酚钠,但甲苯不溶于水,可用分液的方法分离,故A选;
B.加溴水生成三溴苯酚,三溴苯酚和溴都能与甲苯互溶,不能将二者分离,并引入新的杂质,故B不选;
C.温度过高不利于分液存在,且温度降低后会析出苯酚,该方法不是最佳方法,故C不选;
D.由于甲苯中含有少量的苯酚,加热蒸馏不能完全将二者分离,效果不好,故D不选;
故选A.
点评 本题考查化学实验方案的评价,题目难度中等,明确常见化学实验基本操作方法即可解答,试题有利于提高学生的分析能力及化学实验能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,33.6 L氟化氢中含有氟原子的数目为1.5NA | |
| B. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA | |
| C. | 50 mL 18.4 mol•L-1浓硫酸与足量铜加热反应,生成SO2分子的数目为0.46NA | |
| D. | 将含有0.1 mol FeCl3的饱和溶液滴入沸水中,生成的胶体中含胶体粒子的数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用催化设施,可以将汽车尾气中CO和NO转化为无害气体 | |
| B. | 用热的纯碱溶液洗去油污,原理是Na2CO3溶液水解显碱性 | |
| C. | 高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,既能杀菌消毒又能净水 | |
| D. | 光导纤维的主要成分是晶体硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
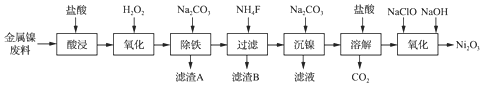
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 1.1 | 6.5 | 7.1 |
| 沉淀完全的pH | 3.2 | 9.7 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
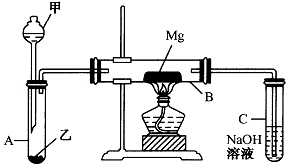 已知SiO2、SO2和CO2都是酸性氧化物,化学性质具有一定的相似性;Mg和Na的化学性质也具有一定相似性.
已知SiO2、SO2和CO2都是酸性氧化物,化学性质具有一定的相似性;Mg和Na的化学性质也具有一定相似性.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6.4gO2和O3的混合气体,含氧原子数为0.4NA | |
| B. | 分子标准状况下,11.2LCCl4中含分子数为0.5NA | |
| C. | 1mol乙酸(忽视挥发损失)与足量的C2H518OH在浓硫酸作用下加热,充分反应可生成NA个CH3CO18OC2H5 | |
| D. | 常温常压下,7.8gNa2O2含离子数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,2.24 L SO2与O2混合气体中所含氧原子数小于0.2NA | |
| B. | 点解饱和食盐水时,当溶液pH由7变为13,电路中转移的电子数为0.1NA | |
| C. | 常温下,1 L pH=13的Ba(OH)2中含有的OH-数目为0.2NA | |
| D. | 10 mL 98%的H2SO4溶液,加入水中稀释至100 mL,H2SO4的质量分数为9.8% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com