
【题目】下列实验操作规范且能达到目的的是
目的 | 操作 | |
A. | 取20.00 mL盐酸 | 在50 mL酸式滴定管中装入盐酸,调整初始读数为30.00mL后,将剩余盐酸放入锥形瓶 |
B. | 清洗碘升华实验所用试管 | 先用酒精清洗,再用水清洗 |
C. | 测定醋酸钠溶液pH | 用玻璃棒蘸取溶液,点在湿润的pH试纸上 |
D. | 配制浓度为0.010 | 称取KMnO4固体0.158 g,放入100 mL容量瓶中,加水溶解并稀释至刻度 |
A. A B. B C. C D. D
科目:高中化学 来源: 题型:
【题目】在研究金属钠与水反应的实验中,反应过程中所观察到的现象与金属钠的下列性质无关的是( )
A. 钠的熔点低
B. 钠的密度小
C. 钠的硬度小
D. 钠的金属活动性很强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】福酚美克是一种影响机体免疫力功能的药物,可通过以下方法合成:
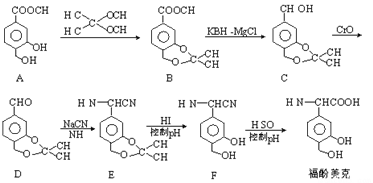
(1)B中的含氧官能团有______________和______________(填名称)。
(2)C→D的转化属于_______________反应(填反应类型)。
(3)已知E→F的转化属于取代反应,则反应中另一产物的结构简式为_______________。
(4)A(C9H10O4)的一种同分异构体X满足下列条件:
Ⅰ.X分子有中4种不同化学环境的氢。
Ⅱ.X能与FeCl3溶液发生显色反应。
Ⅲ.1molX最多能与4molNaOH发生反应。
写出该同分异构体的结构简式:_______________。
(5)已知: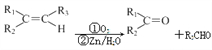 ,根据已有知识并结合相关信息,写出以
,根据已有知识并结合相关信息,写出以![]() 为原料制备
为原料制备 的合成路线流程图(无机试剂任用)______。
的合成路线流程图(无机试剂任用)______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X位于第四周期,其基态原子有4个未成对电子。Y原子最外层电子数是其内层电子总数的3倍,元素Z基态原子的3p轨道上有4个电子,W原子的2p轨道上有3个未成对电子。
(1)Y与W、Z可形成多种化合物。
①元素Y与Z中电负性较大的是_________________(用元素符号描述)。
②离子ZY32-的空间构型为_______________ (用文字描述),杂化方式______________。
③ZY2空间构型_________,杂化方式________,分子的极性________(填“极性”或“非极性”)。
④元素Y与W中第一电离能较大的是___________________(用元素符号描述)。
(2)Y的氢化物(H2Y)在乙醇中的溶解度大于H2Z,其原因是_____________。
(3)含X2+的溶液与KCN、氨水反应可得到化合物K3[X(CN)5(NH3)]。
①基态X2+的电子排布式是________________。
②1 mol配合物K3[X(CN)5(NH3)]中含σ键的数目为___________。
③画出X原子的价电子排布图___________________;
④ [X(CN)5(NH3)]3-配离子中存在的化学键类型有_____________(填序号):
a、配位键 b、氢键 c、极性共价键 d、非极性共价键 e、离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,将一定量碳酸氢铵固体置于容积不变密闭容器中,发生反应:
NH4HCO3(s)![]() NH3(g)+H2O(g)+CO2(g) △H=QkJ/mol(Q>0)。下列有关说法不正确的是
NH3(g)+H2O(g)+CO2(g) △H=QkJ/mol(Q>0)。下列有关说法不正确的是
A. 若容器内混合气体的密度不变,则说明反应达到平街状态
B. 若CO2体积分数不再发生变化,则说明反应达到平街状态
C. 若升高体系温度,则正、逆反应速率均增大
D. 若反应过程中吸收QkJ热量,则刚好有lmol NH4HCO3发生分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法中不正确的是( )
A. 某温度时的混合溶液中c(H+)=![]() mol·L-1,说明该溶液呈中性
mol·L-1,说明该溶液呈中性
B. 常温下,由水电离出的c(H+)=10-12mol·L-1的溶液的pH可能为2或12
C. 已知Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12,向含有Cl-、CrO42-且浓度均为0.010 mol·L-1溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,CrO42-先产生沉淀
D. 常温下pH=7的CH3COOH和CH3COONa混合溶液中,c(Na+)=c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某中学探究性学习小组拟用锌粒与足量稀盐酸反应测定通常状况(约20 ℃,1 atm)下H2的气体摩尔体积。设计实验装置和实验步骤如下:
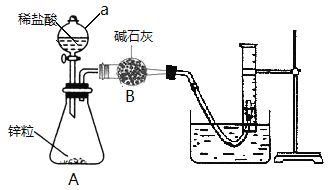
①连接如图所示装置,并检查装置的气密性
②向a仪器中装入VmL稀盐酸,锥形瓶中加入锌粒,B中加入碱石灰;
③称取A装置和B仪器和药品的总质量,记为m g;
④采取措施使装置A中发生反应;
⑤反应停止后,测得在通常状况下收集的气体体积为b mL;
⑥再次称量A装置和B仪器得总质量(含内装物质),记为n g;
⑦处理数据等。
(1)仪器a的名称为_____________。
(2)写出锥形瓶中发生反应的离子方程式____________________________________________________________。
(3)写出检查装置A气密性的方法______________________________________________________________________。
(4)根据上述数据,计算在通常状况下,H2的摩尔体积Vm=__________________________L·mol-1(用含m、b、n等字母的代数式表示)。
(5)若拆除B仪器(其他仪器不变),_______________________________(填“会”或“不会”)对本实验产生影响,理由是______________________________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制硫酸中的一步重要反应是SO2在400~500 ℃下的催化氧化:2SO2+O2![]() 2SO3,这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法中错误的是( )
2SO3,这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法中错误的是( )
A. 使用催化剂是为了加快反应速率,提高生产效率
B. 在上述条件下,SO2不可能100%地转化为SO3
C. 为了提高SO2的转化率,应适当提高O2的浓度
D. 达到平衡时,SO2的浓度与SO3的浓度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A、B均为合成某种抗支气管哮喘药物的中间体,如图所示,A在一定条件下可转化为B,下列说法错误的是

A. 分子B中只含有3种官能团
B. 分子A中所有碳原子不可能位于同一平面
C. 分子B能发生银镜反应,但不能发生水解反应
D. 用FeCl3溶液可检验物质B中是否混有A
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com