
下列说法错误的是( )
A. Na2SO3与BaCl2溶液作用,有白色沉淀生成,加稀HNO3后沉淀消失
B. 将SO2气体分别通入Ba(OH)2溶液、FeCl3与BaCl2的混合溶液、HNO3酸化的BaCl2溶液中,均可有白色沉淀生成
C.将SO2气体通入BaCl2溶液中没有白色沉淀生成,将SO2气体通入Ba(NO3)2溶液中有白色沉淀生成
D.将SO2气体、Cl2一起通入BaCl2溶液中,或将SO2气体、NO2气体一起通入BaCl2 溶液中,均有白色沉淀生成
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源:2016-2017学年江西省高二12月月考化学卷(解析版) 题型:选择题
对于常温下pH=1的硝酸溶液,有关叙述:
①该溶液1mL稀释至100mL后,pH=3
②向该溶液中加入等体积、pH=13的氢氧化钡溶液恰好完全中和
③该溶液中硝酸电离出的c(H+)与水电离出的c(H+)之比值为1×10﹣12
④向该溶液中加入等体积、等浓度的氨水,所得溶液pH=7
其中正确的是( )
A.①② B.①③ C.②④ D.③④
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南浏阳一中等两校高二12月联考化学卷(解析版) 题型:填空题
某研究小组在实验室探究氨基甲酸铵(NH2COONH4)的分解反应。
(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)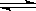 2NH3(g)+CO2(g)
2NH3(g)+CO2(g)
实验测得不同温度下的平衡数据列于下表 :
:
温度/℃ | 15 | 20 | 25 | 30 | 35 |
平衡总压强/kPa | 5.7 | 8.3 | 12 | 17.1 | 24 |
平衡气体 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 | 9.4×10-3 |
①该可逆反应的平衡常数的表达式为________________________
②可以判断该分解反应已经达到平衡的是________。
A.2v(NH3)=v(CO2)
B.密闭容器中混合气体的密度不变
C.密闭容器中CO2的体积分数不变
D.密闭容器中总压强不变
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25 ℃下达到分解平衡。若在恒温下增大容器体积,氨基甲酸铵固体的质量将________(填“增加”、“减少”或“不变”)。
④该反应的焓变ΔH_________0(填“>”、“=”或“<”)
(2)在高温下一氧化碳可将二氧化硫还原为单质硫。
已知:①C(s)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1
②CO2(g)+C(s)===2CO(g) ΔH2=+172.5 kJ·mol-1
③S(s)+O2(g)===SO2(g) ΔH3=-296.0 kJ·mol-1
请写出CO与SO2反应的热化学方程式
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南浏阳一中等两校高二12月联考化学卷(解析版) 题型:选择题
25℃和1.01×105Pa时,2N2O5(g) 4NO2(g)+O2(g) △H=+56.7 kJ/mol,其自发进行的原因是( )
4NO2(g)+O2(g) △H=+56.7 kJ/mol,其自发进行的原因是( )
A.反应是放热反应 B.反应是吸热反应
C.熵增大效应大于能量效应 D.是熵减小的反应
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江哈尔滨六中高一上期末化学卷(解析版) 题型:实验题
Ⅰ、实验室采用MgCl2、 AlCl3的混合溶液与过量氨水反应
AlCl3的混合溶液与过量氨水反应 制备MgAl2O4,主要流程如下:
制备MgAl2O4,主要流程如下:
(1)写出AlCl3与氨水反应的化学反应方程式_________________________。
(2)判断流程中沉淀是否洗净所用的试剂是 ,高温焙烧时,用于盛放固体的仪器名称是 。
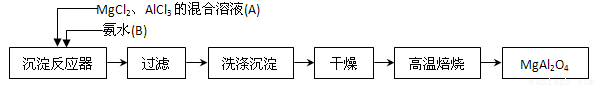
Ⅱ、无水AlCl3(183 ℃升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。
(3)其中装置A用来制备氯气,写出其离子反应方程式:______________________。
(4)装置B中盛放饱和NaCl溶液,该装置的主要作用是__________________________。
(5)F中试剂是________。G为尾气处 理装置,其中反应的化学方程式:__________________。
理装置,其中反应的化学方程式:__________________。
(6)制备氯气的反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,探究小组同学提出下列实验方案:与足量AgNO3溶液反应,称量生成的AgCl质量。此方案 (填“可行”,“不可行”),理由是_________________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江哈尔滨六中高一上期末化学卷(解析版) 题型:选择题
为确定下列置于空气中的物质是否变质,所选检验试剂(括号内物质)不能达到目的的是( )
A. NaOH溶液[Ba(OH)2溶液]
B. FeSO4溶液(KSCN溶液)
C. KI(淀粉溶液)
D. Na2SO3溶液(BaCl2溶液)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江哈尔滨六中高一上期末化学卷(解析版) 题型:选择题
下列图示与对应的叙述相符的是( )
A.四种基本反应类型与氧化还原反应的关系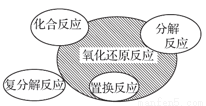
B.AlCl3溶液中滴加NaOH溶液生成沉淀的情况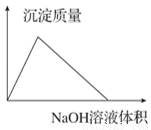
C.Ba(OH)2溶液中滴加硝酸溶液导电性的情况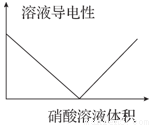
D.等体积等浓度稀硫酸分别与足量铁和镁反应的情况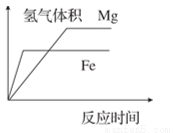
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上月考五化学试卷(解析版) 题型:选择题
能正确表示下列反应的离子方程式是( )
A.碳酸氢铵溶液中加入足量氢氧化钡溶液:NH4++HCO3-+2OH-=CO32-+NH3·H2O+H2O
B.NaNO2溶液中加入酸性KMnO4溶液:2MnO4-+5NO2-+6H+=2Mn2++5NO3-+3H2O
C.Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-=2Fe 2++I2
D.用惰性电极电解熔融氯化钠: 2Cl-+2H2O=Cl2↑+H2↑+2OH-
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西省高二上期中化学卷(解析版) 题型:填空题
常温下,将某一元素酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
实验编号 | HA物质的量浓度(mol·L-1) | NaOH物质的量浓度(mol·L-1) | 混合后溶液的pH |
甲 | 0.2 | 0.2 | pH=a |
乙 | C1 | 0.2 | pH=7 |
丙 | 0.1 | 0.1 | pH>7 |
丁 | 0.1 | 0.1 | pH=9 |
请回答下列问题:
(1)不考虑其他组的结果,单从甲组情况分析,如何用a(混合溶液的pH)来说明HA是强酸还是弱酸?
(2)不考虑其他组的结果,单从乙组情况分析,c1是否一定等于0.2mol·L-1?
填(“是”或“否”)。混合溶液中c(A-)与c(Na+)离子浓度的大小关系是 (填序号)
A.前者大 B.后者大 C.一样大 D.无法判断
(3)从丙组结果分析,HA是 酸(“强”或“弱”)。该混合溶液中离子浓度由大到小的顺序是 。
(4)丁组实验所得混合溶液中由水电离出的中c(OH-)= mol·L-1。写出该混合溶液中下列算式的精确结果(不能做近似计算)c(Na+)-c(A-)= mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com