
| A、混合后,溶液中肯定有沉淀生成 |
| B、沉淀生成后溶液中Ag+的浓度为1×10-5 mol?L-1 |
| C、沉淀生成后溶液的pH=2 |
| D、混合后,升高温度,溶液中Ag+的浓度增大 |
| Ksp |
| c(Cl-) |
| 1×10-10 |
| 0.001 |
| 0.05L×0.02mol/L |
| 0.1L |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、AB2 |
| B、AB3 |
| C、A2B3 |
| D、A3B2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、120g NaHSO4固体中含HSO4-的数目为NA |
| B、Na2O2与足量的CO2反应,生成22.4L氧气时转移的电子数为2NA |
| C、电解精炼铜时,每转移1mol电子阳极上溶解的铜原子数为0.5NA |
| D、1L pH=1的H2SO4溶液中含有H+的数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、体系的压强保持不变 |
| B、体系里气体的密度保持不变 |
| C、生成n molNO的同时生成n molCO2 |
| D、体系里气体的平均摩尔质量保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分子中N-Cl键是非极性键 |
| B、分子中不存在孤对电子 |
| C、它的沸点比PCl3沸点低 |
| D、因N-Cl键键能大,所以NCl3的沸点高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2:3:2 |
| B、3:2:2 |
| C、1:2:3 |
| D、3:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
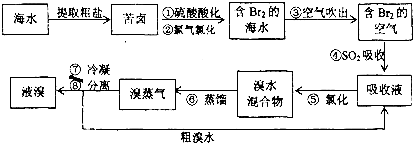
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com