
| A、NaOH溶液 |
| B、CuSO4溶液 |
| C、Na2SO4溶液 |
| D、NaCl溶液 |


 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案科目:高中化学 来源: 题型:
| A、42He原子核内有4个质子 |
| B、42He的最外层电子数为2 |
| C、32He原子核内含有3个质子 |
| D、32He与42He互为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
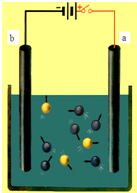 如图是电解氯化铜溶液的装置,其a、b为石墨电极,则下列有关的判断中正确的是( )
如图是电解氯化铜溶液的装置,其a、b为石墨电极,则下列有关的判断中正确的是( )| A、a为正极,b为负极 |
| B、a极上发生还原反应 |
| C、电解过程中,b电极上有铜析出 |
| D、电解过程中,氯离子浓度保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CuO |
| B、CuCO3 |
| C、Cu(OH)2 |
| D、Cu2(OH)2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
- 3 |
2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaOH、H2SO4、Na2SO4 |
| B、NaOH、AgNO3、H2SO4 |
| C、HCl、CuBr2、Ba(OH)2 |
| D、KBr、H2SO4、Ba(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C2H4 与 C3H4O |
| B、C2H2 与 C6H6 |
| C、CH2O 与 C3H6O2 |
| D、CH4 与 C2H4O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 测定时刻/s | t1 | t2 | t3 | t4 |
| n(X)mol | 7 | 3 | 1 | 1 |
| n(Y)mol | 5 | 3 | 2 | 2 |
| n(z)mol | 1 | 3 | 4 | 4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com