
| A. | 溶液的pH值不变 | B. | 溶液中Na2CO3的物质的量不变 | ||
| C. | Na+与CO32-数目不变 | D. | Na2CO3溶液的浓度不变 |
分析 在常温下,用惰性电极电解饱和Na2CO3溶液,在阳极上OH-失电子,电极反应式为4OH--4e-═O2+2H2O;在阴极上是H+得电子,电极反应式为2H++2e-═H2↑,实质是电解H2O,溶质的质量不变、溶剂的质量减小,导致溶液为过饱和溶液,有部分Na2CO3晶体析出,据此分析解答.
解答 解:在常温下,用惰性电极电解饱和Na2CO3溶液,在阳极上OH-失电子,电极反应式为4OH--4e-═O2+2H2O;在阴极上是H+得电子,电极反应式为2H++2e-═H2↑,实质是电解H2O,溶质的质量不变、溶剂的质量减小,导致溶液为过饱和溶液,有部分Na2CO3晶体析出,
A.通过以上分析知,电解后有部分Na2CO3晶体析出,溶液仍然是Na2CO3饱和溶液,溶液浓度不变,则溶液pH不变,故A正确;
B.因为有部分Na2CO3晶体析出,所以导致溶液中Na2CO3的物质的量减少,故B错误;
C.因为有部分Na2CO3晶体析出,所以溶液中Na+与CO32-数目减少,但浓度不变,故C错误;
D.溶液为过饱和溶液,有部分Na2CO3晶体析出,析出晶体后的溶液仍然是饱和溶液,所以碳酸钠溶液浓度不变,故D正确;
故选AD.
点评 本题考查电解原理,为高频考点,明确电解实质是解本题关键,知道电解后溶液中溶质、溶剂如何变化,注意:电解过滤后溶液仍然为饱和溶液,浓度不变.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
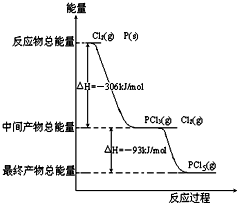 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蛋白质跟浓盐酸作用时呈黄色 | |
| B. | 聚乙烯塑料制品可用于食品的包装,而聚氯乙烯不能用于食品包装 | |
| C. | 木糖醇(C5H12O5)是一种甜味剂,与葡萄糖互为同系物 | |
| D. | 将一小块钠加入乙醇中,钠浮于乙醇上,缓慢反应生成氢气,说明乙醇中羟基上的氢原子相对于水不活泼 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室用溴水和苯在催化剂作用下制溴苯: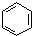 +Br2$\stackrel{FeBr_{3}}{→}$ +Br2$\stackrel{FeBr_{3}}{→}$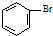 +HBr +HBr | |
| B. | 乙酸乙酯和H${\;}_{2}^{18}$O发生酸性水解反应:CH3COOC2H5+H-18OH $?_{△}^{酸}$CH3CO18OH+C2H5OH | |
| C. | 苯酚钠溶液中通入少量二氧化碳的离子方程式:2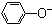 +CO2+H2O→ +CO2+H2O→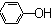 +CO${\;}_{3}^{2-}$ +CO${\;}_{3}^{2-}$ | |
| D. | 甲醛溶液与足量的银氨溶液共热:HCHO+2[Ag(NH3)2]OH$\stackrel{△}{→}$HCOONH4+2Ag↓+3NH3+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
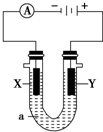 X、Y都是惰性电极,a是饱和NaCl溶液.
X、Y都是惰性电极,a是饱和NaCl溶液.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠能与水反应生成碱,但过氧化钠不是碱性氧化物 | |
| B. | 检验FeCl3溶液中的少量Fe2+,可以用KSCN溶液 | |
| C. | SiO2既能和氢氧化钠溶液反应又能和氢氟酸反应,所以是两性氧化物 | |
| D. | 普通玻璃是纯净物,其组成可用Na2O•CaO•6SiO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com