
【题目】链烃A的核磁共振氢谱显示只含有一种氢原子,A的质谱图中显示其最大质荷比为84,A的红外光谱表明分子中含有碳碳双键。
(1)A的结构简式为____。
(2)在图中,D1、D2互为同分异构体,E1、E2互为同分异构体。
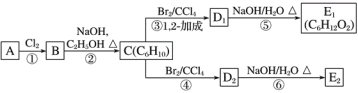
C的化学名称是___;反应⑤的化学方程式为____;E2的结构简式是____;②、⑥的反应类型依次____、___。
【答案】(CH3)2C=C(CH3)2 2,3-二甲基-1,3-丁二烯 CH2BrCBr(CH3)C(CH3)=CH2+2NaOH![]() HOCH2C(OH)(CH3)C(CH3)=CH2+2NaBr HOCH2C(CH3)=C(CH3)CH2OH 消去反应 取代反应
HOCH2C(OH)(CH3)C(CH3)=CH2+2NaBr HOCH2C(CH3)=C(CH3)CH2OH 消去反应 取代反应
【解析】
链烃A的质谱图表明其相对分子质量为84,令组成为CxHy,则x最大值为![]() =7,红外光谱表明分子中含有碳碳双键,所以A为烯烃,所以x=6,y=12,因此A的化学式为C6H12,核磁共振氢谱表明分子中只有一种类型的氢,故A的结构简式为(CH3)2C=C(CH3)2,A与氯气反应生成B,B为(CH3)2CClCCl(CH3)2,B在氢氧化钠、乙醇作用下加热,发生消去反应生成C,C为CH2=C(CH3)C(CH3)=CH2,C与溴发生1,2-加成生成D1,故D1为CH2BrCBr(CH3)C(CH3)=CH2,D1在氢氧化钠水溶液中发生水解反应生成E1,E1为HOCH2C(OH)(CH3)C(CH3)=CH2,D1、D2互为同分异构体,故反应④发生1,4-加成,D2为CH2BrC(CH3)=C(CH3)CH2Br,D2在氢氧化钠水溶液中发生水解反应生成E2,E2为HOCH2C(CH3)=C(CH3)CH2OH,
=7,红外光谱表明分子中含有碳碳双键,所以A为烯烃,所以x=6,y=12,因此A的化学式为C6H12,核磁共振氢谱表明分子中只有一种类型的氢,故A的结构简式为(CH3)2C=C(CH3)2,A与氯气反应生成B,B为(CH3)2CClCCl(CH3)2,B在氢氧化钠、乙醇作用下加热,发生消去反应生成C,C为CH2=C(CH3)C(CH3)=CH2,C与溴发生1,2-加成生成D1,故D1为CH2BrCBr(CH3)C(CH3)=CH2,D1在氢氧化钠水溶液中发生水解反应生成E1,E1为HOCH2C(OH)(CH3)C(CH3)=CH2,D1、D2互为同分异构体,故反应④发生1,4-加成,D2为CH2BrC(CH3)=C(CH3)CH2Br,D2在氢氧化钠水溶液中发生水解反应生成E2,E2为HOCH2C(CH3)=C(CH3)CH2OH,
(1)由上述分析可知,A的结构简式为:(CH3)2C=C(CH3)2;
答案为(CH3)2C=C(CH3)2。
(2)C为CH2=C(CH3)C(CH3)=CH2,则化学名称是2,3-二甲基-1,3-丁二烯;反应⑤的化学方程式为CH2BrCBr(CH3)C(CH3)=CH2+2NaOH ![]() HOCH2C(OH)(CH3)C(CH3)=CH2+2NaBr;E2的结构简式是HOCH2C(CH3)=C(CH3)CH2OH,②的反应类型消去反应,⑥的反应类型取代反应;
HOCH2C(OH)(CH3)C(CH3)=CH2+2NaBr;E2的结构简式是HOCH2C(CH3)=C(CH3)CH2OH,②的反应类型消去反应,⑥的反应类型取代反应;
答案为2,3-二甲基-1,3-丁二烯,CH2BrCBr(CH3)C(CH3)=CH2+2NaOH ![]() HOCH2C(OH)(CH3)C(CH3)=CH2+2NaBr,HOCH2C(CH3)=C(CH3)CH2OH,消去反应,取代反应。
HOCH2C(OH)(CH3)C(CH3)=CH2+2NaBr,HOCH2C(CH3)=C(CH3)CH2OH,消去反应,取代反应。


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:
【题目】已知:6g碳不完全燃烧所得产物中,CO与CO2的体积比为2∶3,且:C(s)+O2(g)=CO(g) ΔH=-110.35kJ·mol-1 CO(g)+O2(g)=CO2(g) ΔH=-282.57 kJ·mol-1。与6g碳完全燃烧相比,损失的热量为( )
A.56.51kJB.110.35kJC.196.46kJD.282.57kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于有机物a(![]() )、b(
)、b(![]() )、c(
)、c(![]() )的说法正确的是( )
)的说法正确的是( )
A.a、b、c的分子式均为C8H8
B.a、b、c中只有a的所有原子可能处于同一平面
C.a、b、c的一氯代物中,b有1种,a、c均有5种(不考虑立体异构)
D.a、b、c均能与溴水发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,不溶于水,易溶于醇等有机溶剂。实验室制备1,2-二溴乙烷的反应原理如下:
CH3CH2OH![]() CH2=CH2+H2O
CH2=CH2+H2O
CH2=CH2+Br2→BrCH2CH2Br
已知:①乙醇在浓硫酸存在下在140℃脱水生成乙醚
2CH3CH2OH![]() CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
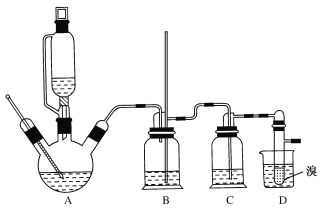
②实验中常因温度过高而使乙醇和浓硫酸反应生成少量SO2和CO2,用12.0g溴和足量的乙醇制备1,2-二溴乙烷,实验装置如图所示:
有关数据列表如下:
类别 | 乙醇 | 1,2-二溴乙烷 | 乙醚 |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g·cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)在此制备实验中,A中按最佳体积比3﹕1加入乙醇与浓硫酸后,A中还要加入几粒碎瓷片,其作用是___。要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是___。
(2)装置B的作用是作安全瓶,瓶中盛水,除了可以防止倒吸以外,还可判断装置是否堵塞,若堵塞,B中现象是____。
(3)在装置C中应加入NaOH溶液,其目的是____。
(4)装置D中小试管内盛有液溴,判断该制备反应已经结束的最简单方法是___。
(5)将1,2—二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在___层(填“上”或“下”)。若产物中有少量未反应的Br2,最好用___洗涤除去;若产物中有少量副产物乙醚,可用____(填操作方法名称)的方法除去。
(6)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是___。
(7)若实验结束后得到9.4g产品,1,2—二溴乙烷的产率为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,2—二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.18g·cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验室中可以用如图所示装置制备1,2—二溴乙烷。其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,用于制备乙烯,试管d中装有液溴(表面覆盖少量水)。下列有关说法不正确的是( )
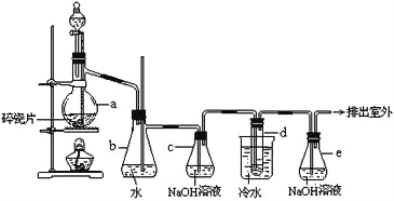
A.实验中为了防止有机物大量挥发,应迅速升高反应温度至170℃
B.装置c和装置e中都盛有NaOH溶液,其吸收的杂质不相同
C.制备乙烯和生成1,2—二溴乙烷的反应类型分别是消去反应和加成反应
D.向d中产物加入饱和Na2CO3溶液震荡静置,可用分液的方法进行分离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸是一种消毒防腐剂,其钠盐可抑制牙膏中微生物的生长。甲苯氧化法是实验室制备苯甲酸的常用方法之一。
(一)反应原理
C6H5CH3+2KMnO4![]() C6H5COOK+KOH+2MnO2↓+H2O
C6H5COOK+KOH+2MnO2↓+H2O
C6H5COOK+HCl→C6H5COOH+KCl
已知:苯甲酸相对分子质量122,熔点122.4℃;苯甲酸在水中的溶解度如下表。
温度/℃ | 17.5 | 25 | 75 | 80 | 100 |
溶解度/g | 3.00 | 3.99 | 5.90 | 8.39 | 11.7 |
(二)实验过程
①将一定量甲苯、水、几粒沸石加入三颈烧瓶中;
②装上冷凝管,加热至沸后分批加入适量高锰酸钾,搅拌回流反应4小时;
③将反应混合物趁热减压过滤,并用热水洗涤滤渣,将洗涤液并入滤液中;
④滤液加入盐酸酸化后,抽滤(装置如图1)、洗涤、干燥得苯甲酸粗产品。
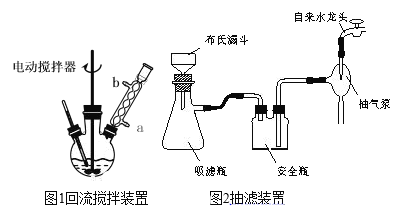
(1)图1电动搅拌器的作用是_____,冷凝管中冷水应从_____(填“a”或“b”)口进入;判断甲苯被氧化完全的实验现象是____。
(2)第③步抽滤操作时,要趁热进行,是因为_____,反应混合物趁热减压过滤后,若溶液呈红色,可用少量NaHSO3溶液处理,反应的离子方程式为_____。
(三)纯度测定
(3)称取1.22g产品溶解在甲醇中配成100mL溶液,移取25.00mL溶液,用KOH标准溶液进行滴定,消耗KOH的物质的量为2.30×10-3mol,产品中苯甲酸质量百分数为____(保留两位有效数字)。
(四)实验反思
(4)得到的粗产品要进一步提纯苯甲酸,可采用_____的方法。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用乙醇和浓硫酸加热反应制取乙烯,请回答下列问题:
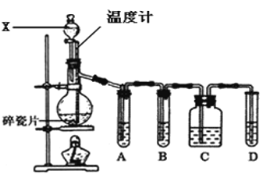
(1)写出实验室制乙烯的化学反应方程式:___,该反应中浓硫酸的作用是:___,___。
(2)有人设计下列实验以确认上述混合气体中有乙烯和二氧化硫。试回答下列问题:
①图中A、B、C、D4个装置可盛放的试剂是A___,B___,C___,D__(将下列有关试剂的名称填入空格内)。
(1)品红溶液 (2)NaOH溶液 (3)KMnO4溶液
②能说明二氧化硫气体存在的现象是___。
③使用装置B的目的是___。
④使用装置C的目的是___。
⑤能证明含有乙烯的现象是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 常温下,pH=4的CH3COOH溶液中,由水电离的c(H+) = 10-10 mol/L
B. 将pH=2的HCl溶液和pH=4的H2SO4溶液等体积混合,所得溶液pH=3
C. 0.1 mol/L氨水和0.1 mol/L NH4Cl溶液等体积混合后所得溶液pH>7,则c(NH4+) < c(NH3·H2O)
D. 向0.1 mol/L、pH=1的NaHA溶液中加入NaOH溶液反应的离子方程式为:HA-+ OH- = H2O + A2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开。在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。
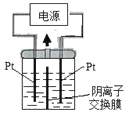
已知:3I2+6OH—=IO3—+5I—+3H2O
下列说法不正确的是
A. 右侧发生的电极方程式:2H2O+2e—=H2↑+2OH—
B. 电解结束时,右侧溶液中含有IO3—
C. 电解槽内发生反应的总化学方程式KI+3H2O=KIO3+3H2↑
D. 如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学方程式不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com