
| A. | 向Fe(NO3)2稀溶液中加入盐酸:Fe2++2H+═3Fe2++H2↑ | |
| B. | 铜片放入稀硝酸中:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| C. | 碳酸氢铵溶液与足量的NaOH溶液混合后加热:NH4++OH-═NH3↑+H2O | |
| D. | AlCl3溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
分析 A.硝酸根离子在酸性条件下将亚铁离子氧化成铁离子,不会生成氢气;
B.铜与稀硝酸反应生成硝酸铜、一氧化氮气体和水;
C.氢氧化钠足量,碳酸氢根离子和铵根离子都完全反应,漏掉了碳酸氢根离子与氢氧根离子的反应;
D.氨水为弱碱,二者反应生成氢氧化铝沉淀.
解答 解:A.向Fe(NO3)2稀溶液中加入盐酸,亚铁离子被氧化成铁离子,正确的离子方程式为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,故A错误;
B.铜片放入稀硝酸中,发生反应的离子方程式为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,故B正确;
C.碳酸氢铵溶液与足量的NaOH溶液混合后加热,反应生成碳酸钠和氨气,反应的离子方程式为:NH4++HCO3-+2OH- $\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+CO32-+2H2O,故C错误;
D.AlCl3溶液中加入过量氨水,二者反应生成氯化铵和氢氧化铝沉淀,正确的离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故D错误;
故选B.
点评 本题考查了离子方程式的书写判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法,如:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | X中含有碳碳双键 | B. | X中含有一个羧基和两个羟基 | ||
| C. | X中含有两个羧基和一个羟基 | D. | X中含有三个羟基和一个-COOR |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 2 | c | d | |||||
| 3 | a | b | e | f |
| A. | e的氢化物比d的氢化物稳定 | |
| B. | a、b、e三种元素的原子半径:e>b>a | |
| C. | 六种元素中,c元素单质的化学性质最活泼 | |
| D. | c、e、f的最高价氧化物对应的水化物的酸性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 实验操作 | |
| A | 验证乙炔能被酸性高锰酸 钾溶液氧化 | 将电石与饱和食盐水反应生成的气体通入酸性 高锰酸钾溶液,观察溶液是否褪色 |
| B | 验证苯和液溴在FeBr3的 催化下发生取代反应 | 将反应产生的混合气体通入AgNO3溶液上方, 观察是否有淡黄色沉淀生成 |
| C | 除去乙酸乙酯中混有的少 量乙酸 | 加入足量饱和Na2CO3溶液,振荡,静置,分液, 取出上层液体 |
| D | 检验溴乙烷中的溴元素 | 取少量溴乙烷,与氢氧化钠溶液共热后加入硝 酸银溶液,观察是否出现淡黄色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
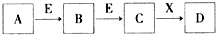
| A. | 若D是一种白色沉淀,在空气中最终变为红褐色,则A可能是氯气 | |
| B. | 若D是一种强碱,则A、B、C均可与X反应生成D | |
| C. | 若D为NaCl,且A可与C反应生成B,则E一定是CO2 | |
| D. | 若D是一种强酸,则A既可以是单质,也可以是化合物,且D可与铜反应生成B或C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
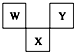 如图是周期表中短周期的一部分,W、X、Y三种元素原子核外电子数之和等于X的质量数,X原子核内质子数和中子数相等.下列叙述中不正确的是( )
如图是周期表中短周期的一部分,W、X、Y三种元素原子核外电子数之和等于X的质量数,X原子核内质子数和中子数相等.下列叙述中不正确的是( )| A. | 三种元素的原子半径的大小顺序是W<Y<X | |
| B. | W最高价氧化物对应水化物具有强酸性,气态氢化物的水溶液具有弱碱性 | |
| C. | X元素的氧化物、氢化物的水溶液都呈酸性 | |
| D. | Y元素的单质是非金属单质中唯一能跟水发生剧烈反应的单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

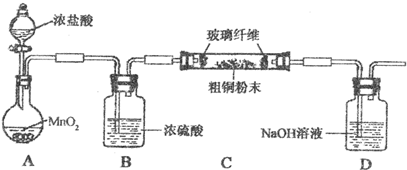
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 142g | B. | 71g | C. | 小于71 g | D. | 大于142 g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com