
【题目】丙烯和乙烯都是石油化工最重要的基础原料,可用于生产多种重要的有机化工产品。主要的工业生产途径如下:
途径I:CH3CH2CH3(g) ![]() CH2=CHCH3(g)+H2(g) △H1
CH2=CHCH3(g)+H2(g) △H1
途径II :nCH3OH(g) ![]() CnH2n(g)+nH2O(g)(n为2或3) △H2<0
CnH2n(g)+nH2O(g)(n为2或3) △H2<0
回答下列问题:
(1)已知:丙烷、丙烯、氢气的燃烧热分别为2219.9 kJ·mol-1 、2056.5 kJ·mol-1 和285.8 kJ·mol-1 ,则△H1=________ kJ·mol-1 。
(2)途径I制备丙烯,要提高丙烯的产率最好采用____________条件。(填“高压”或“低压”)
(3)途径II控制适当的条件(温度、压强、催化剂等)可以调节N(N=n(乙烯)/n(丙烯))在0~1.5之向变化,回答下列问题:
①要大幅度提高丙烯在最终产物中的比率,需要控制的适当条件是______________________。
②在体积为1m3的反应器中投入0.64t甲醇,1h 后,反应器中的压强增加了30%,则甲醇的转化率为______(用N=1进行计算)。
(4)以丙烷为燃料制作新型燃料电池,电池的正极通入O2 和CO2,负极通入丙烷,电解质是熔融碳酸盐。
①写出该电池负极的电极反应式:_____________,CO32-移向电池的___极 (填“正”或“负”)。
②当电池消耗0.005mol C3H8时,正极消耗气体的总体积为_____L (标准状况下)。
③用该电池电解1000mL1mol/L的AgNO3溶液、此电解池的总反应方程式为____________。
【答案】 +122.4 低压 加入高选择性的催化剂 75% C3H8-20e-+10CO32-==13CO2+4H2O 负 1.68 4AgNO3+2H2O![]() 4Ag+O2↑+4HNO3
4Ag+O2↑+4HNO3
【解析】(1)对应的热化学方程式为:①C3H8(g)+5O2 (g)=3CO2(g)+4H2O(l) △H3=-2219.9 kJ·mol-1
②H2(g)+1/2O2(g)=H2O(l) △H4=-285.8 kJ·mol-1
③ C3H6(g)+9/2O2(g)=3CO2(g)+3H2O(l) △H5=-2056.5 kJ·mol-1
-②-③可得:CH3CH2CH3(g) ![]() CH2=CHCH3(g)+H2(g) △H1=△H3-△H4-△H5
CH2=CHCH3(g)+H2(g) △H1=△H3-△H4-△H5
所以△H1=△H3-△H4-△H5=-2219.9 kJ·mol-1+285.8 kJ·mol-1+2056.5 kJ·mol-1= +122.4 kJ·mol-1。
(2)CH3CH2CH3(g) ![]() CH2=CHCH3(g)+H2(g) (g)是一个气体分子数增大的反应,所以低压,有利于平衡正向移动,提高丙烯的产率,故答案为低压。
CH2=CHCH3(g)+H2(g) (g)是一个气体分子数增大的反应,所以低压,有利于平衡正向移动,提高丙烯的产率,故答案为低压。
(3)①有些催化剂具有化学选择性,只能催化某一个反应,使该反应成为最主要的反应,从而提高特定的产物在所有产物中的比例,故答案为:加入高选择性的催化剂。②当生产的乙烯和丙烯的物质的量之比为1:1时,发生的反应的方程式为5CH3OH![]() C2H4+C3H6+5H2O,设反应的甲醇的物质的量为x,根据压强比等于气体的物质的量之比,利用差量法解答:
C2H4+C3H6+5H2O,设反应的甲醇的物质的量为x,根据压强比等于气体的物质的量之比,利用差量法解答:
5CH3OH![]() C2H4+C3H6+5H2O △n
C2H4+C3H6+5H2O △n
5 1+1+5-5=2
x 0.64×106/32×30%=6×103
所以有![]() =
=![]() 解得x=15000,所以甲醇的转化率=15000÷(0.64×106÷32)×100% =75% 。
解得x=15000,所以甲醇的转化率=15000÷(0.64×106÷32)×100% =75% 。
(4)①燃料电池中燃料丙烷所在的电极作负极,丙烷失去电子生成CO2和H+,H+与电解质中的CO32-能继续反应,所以电极方程式为C3H8-20e-+10CO32-==13CO2+4H2O;原电池中CO32-移向负极。②消耗0.005mol C3H8时转移的电子的物质的量为0.1mol,正极的电极方程式为:O2+2CO2+4 e-=2CO32-,所以总共消耗的气体的体积为3/4×0.1×22.4L= 1.68L。③电解AgNO3溶液时,阳极OH-放电生成O2,溶液呈酸性生成HNO3,阴极Ag+得到电子生成Ag单质,总方程式为:4AgNO3+2H2O![]() 4Ag+O2↑+4HNO3。
4Ag+O2↑+4HNO3。


 优生乐园系列答案
优生乐园系列答案科目:高中化学 来源: 题型:
【题目】已知FeSO4在不同条件下分解得到的产物不同,可能是FeO和SO3,也可能是Fe2O3、SO3和SO2。某研究小组探究在酒精喷灯加热条件下FeSO4分解的气体产物。已知SO3的熔点是16.8 ℃,沸点是44.8 ℃。

(1)装置Ⅱ的试管中不装任何试剂,其作用是______________________________,试管浸泡在50 ℃的水浴中,目的是___________________。
(2)装置Ⅲ和装置Ⅳ的作用是探究本实验气体产物成分。请完成实验设计,填写检验试剂、预期现象与结论。
限选试剂:A.3 mol·L-1H2SO4、B.6 mol·L-1NaOH、C.0.5 mol·L-1BaCl2、D.0.5 mol·L-1Ba(NO3)2、E.0.01 mol·L-1酸性KMnO4溶液。(填所选试剂的序号)
检验试剂 | 预期现象和结论 |
装置Ⅲ的试管中加入________ | 产生大量白色沉淀,证明气体产物中含有SO3 |
装置Ⅳ的试管中加入________ | ____________________ |
(3)装置Ⅴ的作用是防止尾气污染环境,烧杯中应加入的试剂是________。
(4) 配平离子方程式,并在![]() 中填上所需的微粒:_______________________
中填上所需的微粒:_______________________
H++ MnO4-+ Fe2+→ Mn2+ Fe3++ ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z和W代表原子序数依次增大的四种短周期主族元素,它们满足以下条件:①在元素周期表中,Z 与Y、W均相邻;②X、Y、W分别位于不同周期;③Y、Z、W三种元素的原子最外层电子数之和为17。 下列说法错误的是
A. 简单阴离子的离子半径:W>Y>Z>X
B. X、Y、Z既能形成离子化合物,又能形成共价化合物
C. W的常见氧化物均为酸性氧化物
D. X分别与Y、Z形成的核外电子总数为10的微粒最多只有5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸多巴胺是选择性血管扩张药,临床上用作抗休克药,合成路线如图所示:
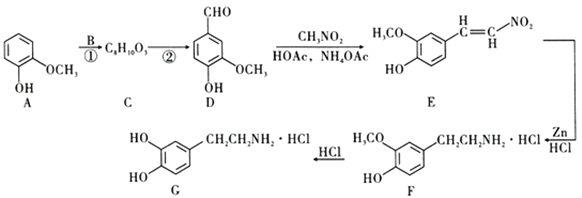
根据上述信息回答:
(1)D的官能团名称为________________________________。
(2)E的分子式为_________________________。
(3)若反应①为加成反应,则B的名称为__________________。
(4)反应②的反应类型为___________________________。
(5)D的一种同分异构体K用于合成高分子材料,K可由HOO![]() CH2Cl制得,写出K在浓硫酸作用下生成的聚合物的化学方程式:_______________________________________。
CH2Cl制得,写出K在浓硫酸作用下生成的聚合物的化学方程式:_______________________________________。
(6)E生成F的化学反应方程式为________________________。
(7)D的同分异构体有多种,同时满足下列条件的有____种。
I.能够发生银镜反应;
II.遇FeCl3溶液显紫色;
III.苯环上只有两种化学环境相同的氢原子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在铁制品上镀上一定厚度的锌层,以下方案设计正确的是( )
A.锌作阳极,镀件作阴极,溶液中含有锌离子
B.铂作阴极,镀件作阳极,溶液中含有锌离子
C.铁作阳极,镀件作阴极,溶液中含有亚铁离子
D.锌作阴极,镀件作阳极,溶液中含有锌离子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com