
分析 (1)溶液的pH=2.0,则c(OH-)=10-12mol/L,根据Ksp[Fe(OH)3]=c(Fe3+)×c3(OH-)计算;
(2)步骤3若未除去Fe3+,则加KI固体时,先发生2Fe3++2I-═2Fe2++I2,后发生2Cu2++4I-═2CuI↓+I2,反应消耗的碘离子的物质的量偏大;
(3)设Cu2S和CuS的物质的最分别为x、y,根据2Cu2+~I2~2S2${{O}_{3}}^{2-}$,利用原子守恒列式求出Cu2S和CuS的物质的量、质量,再求出质量分数.
解答 解:(1)步骤3加入氨水产生沉淀时,溶液的pH=2.0,则c(OH-)=10-12mol/L,Ksp[Fe(OH)3]=c(Fe3+)×c3(OH-),则c(Fe3+)=$\frac{Ksp}{{c}^{3}(O{H}^{-})}$=$\frac{2.6×1{0}^{-39}}{(1{0}^{-12})^{3}}$=2.6×10-3 mol•L-1;
故答案为:2.6×10-3 mol•L-1;
(2)步骤3若未除去Fe3+,则加KI固体时,先发生2Fe3++2I-═2Fe2++I2,后发生2Cu2++4I-═2CuI↓+I2,反应消耗的碘离子的物质的量偏大,所以求出的Cu2+的物质的量将偏高;
故答案为:偏高;
(3)设Cu2S和CuS的物质的最分别为x、y;
2Cu2+~I2~2S2${{O}_{3}}^{2-}$
n(Cu2+)=n(S2${{O}_{3}}^{2-}$)=0.050 00 mol•L-1×14.00×10-3 L=7.000×10-4 mol,
则2x+y=7.000×10-4 mol×$\frac{250mL}{25mL}$…①,
Cu2S和CuS被高锰酸钾氧化为CuSO4,Cu、S元素失去电子的物质的量等于Mn元素得到电子的物质的量,
则10x+8y=0.120 0mol•L-1×0.1L×5-0.100mol•L-1×0.016L×$\frac{250mL}{25mL}$…②,
联立方程式①②,
解得:x=2.000×10-3 mol,y=3.000×10-3 mol,
w(Cu2S)=$\frac{2.000×1{0}^{-3}mol×160g/mol}{0.7500g}$×100%=42.7%,
w(CuS)=$\frac{3.000×1{0}^{-3}mol×96g/mol}{0.7500g}$×100%=38.4%,
答:Cu2S的质量分数为42.7%,CuS的质量分数为38.4%.
点评 本题考查了物质组成分析与化学综合计算题,涉及氧化还原反应滴定、溶度积的计算等,难度中等,注意运用元素守恒进行推理计算,学习中紧紧抓住元素守恒、质量守恒、电荷守恒、极端分析等化学常用分析方法.


 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 食物储存在冰箱里 | |
| B. | 向H2O2溶液中加入MnO2 | |
| C. | 用块状碳酸钙代替粉末状碳酸钙与稀盐酸反应 | |
| D. | 用0.1 mol/L H2SO4溶液代替1 mol/L H2SO4溶液与锌粒反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Al3+、NO3-、HCO3- | B. | H+、Na+、Fe2+、ClO- | ||
| C. | Na+、Ba2+、Cl-、NO3- | D. | K+、NH4+、SO42-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氨汽化时吸收大量的热,可用作制冷剂 | |
| B. | 硅酸钠溶液呈碱性,可用作木材防火剂 | |
| C. | NaHCO3能与碱反应,可用作焙制糕点的膨松剂 | |
| D. | Fe比Cu活泼,可用FeCl3溶液腐蚀线路板上的Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | SiO2(s)+2C(s)═Si(s)+2CO(g)只能在高温下自发进行,则该反应△H>0 | |
| B. | 电镀时,镀层金属跟直流电源的负极相连 | |
| C. | 锅炉内壁上沉积的CaSO4可先用饱和Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除去 | |
| D. | 向100 mL纯水中滴加1 mL浓硫酸,水的离子积常数Kw减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径的大小顺序:r(W)>r(Z)>r(Y) | |
| B. | 元素Z、M的简单离子的电子层结构相同 | |
| C. | W的简单气态氢化物的热稳定性比M的差 | |
| D. | 元素X和Y形成的化合物只有一种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
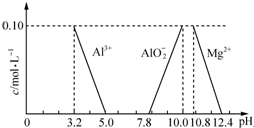 达喜[AlaMgb(OH)c(CO3)d•xH2O]常用于中和胃酸.
达喜[AlaMgb(OH)c(CO3)d•xH2O]常用于中和胃酸.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
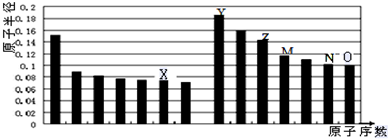
| A. | Y、O两种元素的离子半径相比,前者较大 | |
| B. | Z的氧化物能分别溶解于Y的最高氧化物的水化物和O的氢化物的水溶液 | |
| C. | 由X与Y两种元素组成的化合物只含离子键 | |
| D. | X、N两种元素的气态氢化物的稳定性相比,后者较强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
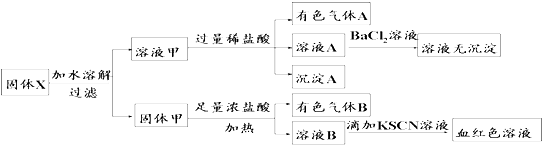
| A. | 溶液甲中一定含有K2SiO3、NaNO2、K2CO3,可能含有KAlO2 | |
| B. | 固体粉末X中可能含有K2SO3 | |
| C. | 气体A和气体B一定均为纯净物 | |
| D. | 原混合物中可能含有Fe2O3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com