
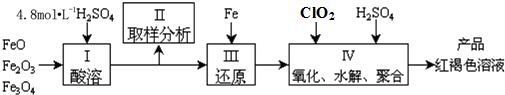
分析 (1)实验室用18.4mol•L-1的浓硫酸配制250mL4.8mol•L-1的硫酸溶液,所需的玻璃仪器有量筒、烧杯、玻璃棒、250mL容量瓶、胶头滴管;
(2)控制水解时Fe3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+必须先还原为Fe2+,所以确定下一步还原所需铁的量,然后Fe2+再被ClO2氧化为Fe3+;
(3)酸性条件下,ClO2将Fe2+氧化为Fe3+,ClO2被还原为Cl-;
(4)①氧化剂氧化性强于氧化产物氧化性;
②mg白色沉淀为BaSO4,由硫酸根守恒n(SO42-)=n(BaSO4),由原子守恒与电电子转移守恒可得关系式:5Fe3+~5Fe2+~MnO4-,根据关系式计算n(Fe3+).
解答 解:(1)实验室用18.4mol•L-1的浓硫酸配制250mL4.8mol•L-1的硫酸溶液,用量筒量取浓硫酸,在烧杯中溶解,并用玻璃棒搅拌,移入2500mL容量瓶,最后需要用胶头滴管定容,
故答案为:250mL容量瓶、胶头滴管;
(2)因为控制水解时Fe3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+必须先还原为Fe2+,所以确定下一步还原所需铁的量,然后Fe2+再被氧化Fe3+,需要确定氧化Fe2+所需ClO2的量,
故答案为:AC;
(3)酸性条件下,ClO2将Fe2+氧化为Fe3+,ClO2被还原为Cl-,反应离子方程式为:5Fe2++ClO2+4H+=5Fe3++Cl-+2H2O,
故答案为:5Fe2++ClO2+4H+=5Fe3++Cl-+2H2O;
(4)①发生反应:Cu+2Fe3+=2Fe2++Cu2+,5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,氧化剂氧化性强于氧化产物氧化性,氧化性由强到弱的顺序:MnO4->Fe3+>Cu2+>Fe2+,
故答案为:MnO4->Fe3+>Cu2+>Fe2+;
②mg白色沉淀为BaSO4,由硫酸根守恒n(SO42-)=n(BaSO4)=$\frac{m}{233}$mol,由原子守恒与电电子转移守恒可得关系式:5Fe3+~5Fe2+~MnO4-,则n(Fe3+)=5n(MnO4-)=5×V×10-3L×0.1mol/L×$\frac{250mL}{25mL}$,
n(SO42-):n(Fe3+)=$\frac{m}{233}$mol:5×V×10-3L×0.1mol/L×$\frac{250mL}{25mL}$=$\frac{m}{233}$:$\frac{V}{200}$,
故答案为:$\frac{m}{233}$:$\frac{V}{200}$.
点评 本题以聚合硫酸铁的制备为载体,考查溶液配制、氧化还原反应配平、氧化性强弱比较、化学工艺流程等,是对学生综合能力的考查,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 工业上用电解熔融氯化镁制单质镁 | |
| B. | 工业上用电解饱和食盐水制氯气 | |
| C. | 工业上用二氧化硅在高温下与焦炭反应制得高纯度的硅 | |
| D. | 工业上炼铁时,常用石灰石除去铁矿石中的SiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烷烃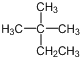 的系统命名为2-甲基-2-乙基丙烷 的系统命名为2-甲基-2-乙基丙烷 | |
| B. | 甲苯苯环上的一个氢原子被含4个碳原子的烷基取代,所得产物有12种 | |
| C. | 乙烯能使溴的四氯化碳溶液和酸性高锰酸钾溶液褪色,其原理相同 | |
| D. | 在碱性条件下,CH3CO18OC2H5的水解产物是CH3COOH和C2H518OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol•L-1CuCl2溶液含有3.01×1023个Cu2+ | |
| B. | 28g聚乙烯分子含有的碳原子数为 NA | |
| C. | 0.2mol PCl5分子中,键数目为NA | |
| D. | 标准状况下,3.36L H2O含有9.03×1023个H2O分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 步骤编号 | 操作过程 | 实验现象 | 实验结论 |
| ① | 氯水有酸性 | ||
| ② | 氯水有漂白性 | ||
| ③ | 氯水中存在Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com