
【题目】下列元素电负性最大的是( )
A. C B. Cl C. F D. N
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D四种物质之间有图所示的转化关系.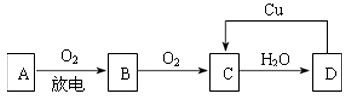
已知,A是空气中的主要成分,B、C、D均为化合物,且C为红棕色气体.
请回答下列问题:
①写出A和C的化学式:A , C .
②B→C观察到的现象是 .
③C→D的化学反应方程式是 , 该反应的氧化剂是 , 还原剂是 .
④在图示D→C的过程中发生反应的化学方程式是 , 其中,D表现出强(填“氧化性”或“还原性”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂—磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:2Na3PO4+4CuSO4+2NH3H2O═Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O
(1)写出基态Cu2+的电子排布式:____________;与Cu同周期的元素中,与铜原子最外层电子数相等的元素还有____________(填元素符号)。
(2)PO43-的空间构型是____________。
(3)与SO42-互为等电子体的2种分子是______。
(4)氨水溶液中各元素原子的电负性从大到小排列顺序为_______________.
(5)氨基乙酸铜(结构简式:H2NCH2COO-Cu-OOC-CH2NH2)分子中碳原子的杂化方式为____________,基态碳原子核外电子占有_________个轨道。
(6)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,则1mol该配合物中含有的π键的物质的量为__________mol。
(7)铜晶体为面心立方最密堆积,配位数为___________,铜的原子半径为127.8pm,NA表示阿伏加德罗常数的值,列出晶体铜的密度计算式(不必化简)__________g/cm-3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】柠檬酸(用HR 表示)是一种高效除垢剂,现用一定浓度的柠檬酸溶液去除水垢,溶液中H3R、H2R-、HR2-、R3-的含量随pH的变化如图所示。下列说法正确的是
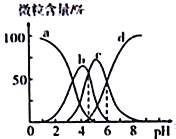
A. H3R的第二步电离常数Ka2(H3R)的数量级为10-4
B. pH=6时,c(R3-)=c(HR2-)>c(H+)>c(OH-)
C. Na2HR溶液中HR2-的水解程度大于电离程度
D. pH=4时,c(H+)=c(H2R-)+2c(HR2-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如下图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )

A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:X>W>Z
C. 最简单气态氢化物的热稳定性:Y>X>W>Z
D. 元素X、Z、W的最高化合价分别与其主族序数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏德罗常数的值,下列叙述正确的是
A.物质的量是一个物理量,它的单位是个
B.常温常压下,11.2 L H2所含的分子数为0.5 NA
C.1 mol 水的质量是18 g
D.MgCl2的摩尔质量为95
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2C(s)+O2(g)===2CO(g) ΔH=-Q1kJ·mol-1;
C(s)+O2(g)===CO2(g) ΔH=-Q2kJ·mol-1;
S(s)+O2(g)===SO2(g) ΔH=-Q3kJ·mol-1。
CO与镍反应会造成镍催化剂中毒,为防止镍催化剂中毒,工业上常用SO2将CO氧化,二氧化硫转化为单质硫,则该反应的热化学方程式为 ( )
A. SO2(g)+2CO(g)===S(s)+2CO2(g) ΔH=(2Q1-2Q2+Q3) kJ·mol-1
B. S(s)+2CO(g)===SO2(g)+2C(s) ΔH=(Q1-Q3) kJ·mol-1
C. SO2(g)+2CO(g)===S(s)+2CO2(g) ΔH=(Q1-2Q2+Q3) kJ·mol-1
D. SO2(g)+2CO(g)===S(s)+2CO2(g) ΔH=(2Q1-Q2+2Q3) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)人的纯净胃液是一种无色而呈酸性的液体,pH在0.9~1.5之间,胃液中含有大量盐酸,其中的H+浓度比血液高几百万倍,试回答下列问题:
①若胃液酸度增高就患胃酸过多症,下列物质不宜用作治疗胃酸过多症药物的主要成分的是(____)
A.小苏打粉 B.氢氧化铝粉 C.氧化钙粉 D.纯碳酸钙粉
②胃溃疡患者胃酸过多可考虑选用①中的 ________________。(填字母编号)写出反应的化学方程式______________________________ 。
(2)现有下列四种物质:A.食盐B.食醋 C.苹果汁 D.葡萄糖,请按下列要求填空(填序号)。
富含维生素C的是_________;可直接进入血液补充能量的是_________;即可作为调味剂,又可预防感冒的是_________;食用过多会引起血压升高、肾脏受损的________。
(3)保护环境、呵护地球已成为为类共同的呼声。
①水是一种宝贵的资源,保护水资源就是保护我们的生命。下列做法不利于水资源保护的是__________(填字母编号);
A.科学合理使用农药 B.任意排放化工厂废水 C.处理生活污水,达标排放
②矿泉水瓶不能随意丢弃。根据垃圾分类方法,矿泉水瓶属于__________(填“可回收物”或“可堆肥垃圾”);
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,尿素电氧化法处理富含尿素的工业废水和生活污水得到了广泛关注,该法具有操作简易、处理量大、运行周期长等优点,且该过程在碱性条件下产生无毒的C02、N2.电池工作时,下列说法错误的是( )

A. 负极发生的反应为:![]()
B. 正极附近溶液的pH增大
C. 隔膜只允许阳离子通过
D. 处理掉废水中尿素1.0g时消耗O2 0.56L(标准状况)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com