
【题目】在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示。关于该装置,下列说法正确的是( )
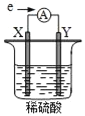
A.外电路中电流方向为:X→![]() →Y
→Y
B.若两电极分别为铁棒和碳棒,则X为碳棒,Y为铁棒
C.X极上发生的是还原反应,Y极上发生的是氧化反应
D.若两电极都是金属单质,则它们的活动性顺序为X>Y
【答案】D
【解析】
根据图片知,该装置是原电池,根据电子的流向判断X为负极,Y为正极,电流的流向正好与电子的流向相反;在原电池中,较活泼的金属作负极,不活泼的金属或导电的非金属作正极;负极上发生氧化反应,正极上发生还原反应。
A. 根据图片知该装置是原电池,外电路中电子从X电极流向Y电极,电流的流向与此相反,即Y→![]() →X,A项错误;
→X,A项错误;
B. 原电池中较活泼的金属作负极,较不活泼的金属或导电的非金属作正极,若两电极分别为Fe和碳棒,则Y为碳棒,X为Fe,B项错误;
C. X是负极,负极上发生氧化反应;Y是正极,正极上发生还原反应,C项错误;
D. X为负极,Y为正极,若两电极都是金属单质,则它们的活动性顺序为 X>Y,D项正确。
答案选D。


科目:高中化学 来源: 题型:
【题目】某同学欲用98%的浓H2SO4(ρ=1.84g/cm3)配制成500mL 0.5mol/L的稀H2SO4
(1)填写下列操作步骤:
①所需浓H2SO4的体积为____。
②如果实验室有10mL、20mL、50mL量筒,应选用___mL量筒量取。
③将量取的浓H2SO4沿玻璃棒慢慢注入盛有约100mL水的___里,并不断搅拌,目的是___。
④立即将上述溶液沿玻璃棒注入____中,并用50mL蒸馏水洗涤烧杯2~3次,并将洗涤液注入其中,并不时轻轻振荡。
⑤加水至距刻度___处,改用__加水,使溶液的凹液面正好跟刻度相平。盖上瓶塞,上下颠倒数次,摇匀。
(2)请指出上述操作中一处明显错误:____。
(3)误差(填偏高、偏低、无影响)
①操作②中量取时发现量筒不干净,用水洗净后直接量取,所配溶液浓度将___;
②问题(2)的错误操作将导致所配制溶液的浓度___;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用除去表面氧化膜的细铝条紧紧缠绕在温度计上(如图),将少许硝酸汞溶液滴到铝条表面,置于空气中,很快铝条表面产生“白毛”,且温度明显上升。下列分析错误的是

A.Al和O2化合放出热量B.硝酸汞是催化剂
C.涉及了:2Al+3Hg2+→2Al3++3HgD.“白毛”是氧化铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某硬铝(含有铝、镁、铜)中铝的含量,设计了Ⅰ、Ⅱ两个方案。根据方案Ⅰ、Ⅱ回答问题:
方案Ⅰ:
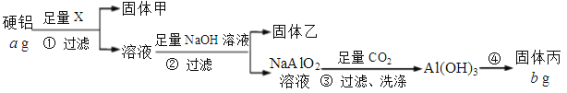
(1)固体甲是铜,试剂X的名称是_______________。
(2)能确认NaOH溶液过量的是___________(选填选项)。
a. 测溶液pH,呈碱性
b. 取样,继续滴加NaOH溶液,不再有沉淀生成
c. 继续加NaOH溶液,沉淀不再有变化
(3)步骤④的具体操作是:灼烧、_______、________,重复上述步骤至恒重。
(4)固体丙的化学式是______,该硬铝中铝的质量分数为_______________。
方案Ⅱ的装置如图所示:
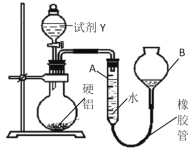
操作步骤有:
①记录A的液面位置;
②待烧瓶中不再有气体产生并恢复至室温后,使A和B液面相平;
③再次记录A的液面位置;
④将一定量Y(足量)加入烧瓶中;
⑤检验气密性,将a g硬铝和水装入仪器中,连接好装置。
(1)试剂Y是________________;操作顺序是______________________。
(2)硬铝质量为a g,若不测气体的体积,改测另一物理量也能计算出铝的质量分数,需要测定的是_______,操作的方法是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】火山爆发产生的气体中含有少量的羰基硫(分子式是:COS),已知羰基硫分子结构与CO2类似,有关说法正确的是( )
A.羰基硫是电解质
B.羰基硫分子的电子式为:![]()
C.C、O、S三个原子中半径最小的是C
D.羰基硫分子为非极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
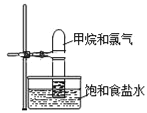
【题目】将如图装置放置在光亮的地方,随后观察到如下实验现象:大试管内壁上有油状液滴生成、饱和食盐水中有少量固体析出、黄绿色气体颜色变浅、试管内液面有所上升。
(1)油状液滴的成分可能是CCl4和___。
(2)水槽中盛放饱和食盐水而不是蒸馏水是为了抑制___与水的反应。
(3)试管内液面上升的原因是___极易溶于水。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将水分解制得氢气的一种工业方法是“硫﹣碘循环法”,依次涉及下列三步反应:
I.SO2+2H2O+I2=H2SO4+2HI
II.2HI(g)H2(g)+I2(g)
III.2H2SO4=2SO2+O2+2H2O
(1)一定温度下,向5L恒容密闭容器中加入1molHI,发生反应II,H2物质的量随时间的变化如图所示。0~2min内的平均反应速率v(HI)=___。相同温度下,若起始加入的HI改为2mol,反应达平衡时H2的量为___mol。
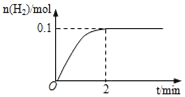
(2)分析上述反应,下列判断错误的是___(填写选项编号,只有一个正确选项)。
a.三步反应均为氧化还原反应
b.循环过程中产生1molH2,同时产生1molO2
c.在整个分解水的过程中SO2和I2相当于催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,某一密闭且体积不变的容器内有可逆反应:A(g)+2B(g) ![]() 2C(g)。该反应进行到一定限度后达到了化学平衡,不能作为判断该化学平衡标志的是
2C(g)。该反应进行到一定限度后达到了化学平衡,不能作为判断该化学平衡标志的是
A.容器内气体A的物质的量不再随时间而改变
B.容器内气体C的浓度不再随时间而改变
C.单位时间内生成amol物质A,同时生成2amol物质B
D.单位时间内生成amol物质A,同时生成2amol物质C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列有关实验装置进行的相应实验中,能达到实验目的的是
A.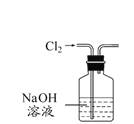 所示装置除去Cl2中含有的少量HCl
所示装置除去Cl2中含有的少量HCl
B.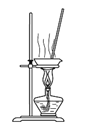 所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
C. 所示装置制取少量纯净的CO2气体
所示装置制取少量纯净的CO2气体
D.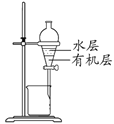 所示装置分离CCl4萃取碘水后已分层的有机层和水层
所示装置分离CCl4萃取碘水后已分层的有机层和水层
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com