

| A. | 甲装置工作过程中pH增大 | |
| B. | 乙装置中石墨电极反应式为C-4e-+2O2-═CO2↑ | |
| C. | 甲装置中通入O2的电极反应式为:O2+4e-+4H+═2H2O | |
| D. | 若不考虑装置的损失,制备24.0g金属钛,需要消耗氢气22.4L |
分析 根据图知,甲为燃料电池,氢气为负极,被氧化,氧气为正极,发生还原反应,乙为电解装置,阳极上电极反应式为C+2O2--4e-═CO2↑,阴极上电极反应式为:2Ca2++4e-═2Ca,钙还原二氧化钛反应方程式为2Ca+TiO2=Ti+2CaO,以此解答该题.
解答 解:A.甲装置总反应为O2+2H2═2H2O,生成水导致磷酸浓度降低,则pH增大,故A正确;
B.乙装置石墨电极为阳极,电极反应式为C+2O2--4e-═CO2↑,故B正确;
C.甲装置通入O2的电极为正极,反应式为O2+4H++4e-═2H2O,故C正确;
D.n(Ti)=$\frac{24.0g}{48g/mol}$=0.5mol,则消耗1molCa,转移2mol电子,由电极方程式H2-2e-═2H+可知,需要1molH2,则在标况下才为22.4 L,故D错误;
故选D.
点评 本题综合考查电解池和原电池知识,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握电极方程式的书写,为解答该类题目的关键,难度中等.


科目:高中化学 来源: 题型:选择题
| 元素 | 元素性质或原子结构的部分信息 |
| W | 元素的离子核外无电子 |
| X | 地壳中含量最多的元素 |
| Y | 元素的离子半径在该周期中最小 |
| Z | Z的单质是淡黄色固体 |
| A. | W与Z形成的化合物在常温下为气体 | |
| B. | Y的最高价氧化物对应的水化物显强碱性 | |
| C. | X和Z形成的常见化合物能形成酸 | |
| D. | 简单氢化物的稳定性:X>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钾保存在乙醇中 | |
| B. | 常温下浓硫酸可存放在铁质容器中 | |
| C. | NaOH溶液保存在玻璃塞的试剂瓶中 | |
| D. | FeCl3溶液中加入少量还原铁粉存放 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
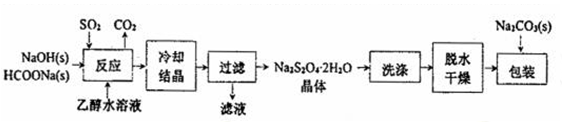

| 绝热恒容(2L ) 密闭容器A | 恒温(T℃)恒容(2L) 密闭容器B | 恒温(T℃)恒压 密闭容器C | |
| 平衡常数K | KA | KB | KC |
| SO2的平衡转化率 | αA | αB | αC |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 常温下,PH均为9的CH3COONa和NaOH溶液中,水的电离程度不相同 | |
| B. | 反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H>0 | |
| C. | 向浓度均为0.1 mol•L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水,先出现蓝色沉淀,说明Ksp[Mg(OH)2]>Ksp[Cu(OH)2] | |
| D. | 已知I${\;}_{3}^{-}$?I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 温度/℃C% 压强/MPa | 0.1 | 10 | 20 |
| 200 | 15.3 | 81.5 | 86.4 |
| 300 | 2.2 | a | 64.2 |
| 400 | 0.4 | 25.1 | 38.2 |
| 500 | 0.1 | 10.6 | 19.1 |
| H2CO3 | H2SO3 | HNO2 | HClO |
| K1=4.4×10-7 K2=4.7×10-11 | K1=1.2×10-2 K2=6.6×10-8 | K=7.2×10-4 | K=2.9×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3O4 | B. | FeO | C. | Fe2O3 | D. | Fe5O7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com