
| A. | ①② | B. | ③④ | C. | ①②③ | D. | ①②③④ |
分析 空气污染的途径主要有两个:有害气体和粉尘.
有害气体主要有一氧化碳、二氧化硫、二氧化氮等气体,二氧化硫主要来源于煤、石油等燃料的燃烧,工厂排放的废气等;一氧化碳主要来源于化石燃料的不完全燃烧和汽车的尾气等;二氧化氮主要来源于机动车排放的废气和燃放烟花爆竹;
粉尘主要指一些固体小颗粒,粉尘主要是地面粉尘、燃煤排放的粉尘、沙尘暴等.
解答 解:①煤燃烧产生的二氧化硫、二氧化氮等都能溶于水生成相应的酸,从而形成酸雨能引起大气污染,故①正确;
②燃放鞭炮产生的二氧化硫能溶于水生成相应的酸,从而形成酸雨能引起大气污染,故②正确;
③工业排放的废气有害气体主要有二氧化硫、二氧化氮等气体,以及燃煤排放的粉尘能引起大气污染,故③正确;
④汽车的尾气中含有二氧化氮等都能溶于水生成相应的酸,从而形成酸雨能引起大气污染,故④正确;
故选D.
点评 本题考查有关环境污染问题,环保问题已经引起了全球的重视,注意“三废”的处理问题是考查的热点问题,题目难度不大.


科目:高中化学 来源: 题型:解答题
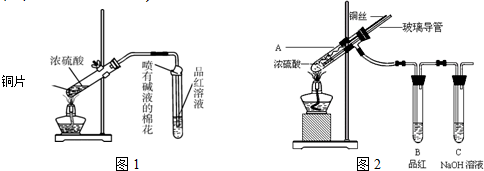
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
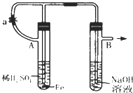 根据实验装置和下述操作,回答下列有关问题:
根据实验装置和下述操作,回答下列有关问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 闪电时大气中氮的氧化物的生成 | |
| B. | 由NH3合成尿素 | |
| C. | 用N2和H2合成氨 | |
| D. | 豆科植物的根瘤菌把大气中的氮转化成氨 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com