
【题目】最近科学家冶炼出纯度高达99.9999%的铁。你估计它不会具有的性质是
A. 硬度比生铁低 B. 与4mol/L的HCl反应时速率比生铁快
C. 在冷的浓硫酸中可钝化 D. 在潮湿的空气中不易生锈
 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
【题目】锂一空气电池是高能量密度的新型电池,结构如图所示。下列说法正确的是( )

A.固体电解质只有Li+可通过
B.电池反应为![]()
C.充电时,水性电解液的pH将升高
D.放电时,若外电路有0. 1mol e -通过时,理论上将消耗1.12 LO2(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg-AgCl电池是一种以海水为电解质溶液的水激活电池,下列叙述错误的是
A.负极反应式为Mg-2e-=Mg2+
B.正极反应式为Ag++e-=Ag
C.电池放电时Cl-由正极向负极迁移
D.负极会发生副反应Mg+2H2O=Mg(OH)2+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液加入金属铝能放出氢气。下列各组离子在该溶液中一定可以大量共存的是
A.Al3+、NH4+、Cl-、SO42-
B.Na+、Cl-、SO42-、HCO3-
C.Na+、CH3COO-、NO3- 、K+
D.K+、Na+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】每年的6月26日是国际禁毒日,珍爱生命,远离毒品。以下是四种毒品的结构简式,下列有关说法正确的是

A. 四种毒品中都含有苯环,都属于芳香烃
B. 摇头丸经消去、加成反应可制取冰毒
C. 1 mol大麻与溴水反应最多消耗4 mol Br2
D. 氯胺酮分子中环上所有碳原子可能共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据事实写出下列反应的热化学方程式。
(1)在25 ℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ。则表示甲醇燃烧热的热化学方程式为____________________________________________。
(2)若适量的N2和O2完全反应,每生成23 g NO2需要吸收16.95 kJ热量,则表示N2和O2反应生成NO2的热化学方程式为________________________________________。
(3)已知拆开1 mol H—H键,1 mol N—H键,1 mol N≡N键分别需要吸收的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.请回答:
(1)MgCl2的电子式 。
(2)除去铜粉中少量铁粉不用稀硝酸,用化学方程式表示其原因 。
(3)往饱和Na2CO3溶液中通入CO2气体,溶液中出现白色浑浊,写出该反应的离子方程式 。
(4)双氧水能使酸性高锰酸钾溶液褪色,请完成以下相关反应的离子方程式:
( )MnO4-+( )H2O2+ =( )Mn2++( )H2O+ 。
Ⅱ.无机化合物A 和NaH都是重要的还原剂,遇水都强烈反应。一定条件下,2.40g NaH与气体B反应生成3.90g化合物A和 2.24L(已折算成标准状况)的H2。已知气体B可使湿润红色石蕊试纸变蓝。
请回答下列问题:
(1)A的化学式是 。
(2)NaH与气体B反应生成化合物A的化学方程式 。
(3)A与足量盐酸发生非氧化还原反应的化学方程式 。
(4)在高温下氢化钠(NaH)可将四氯化钛(TiC14)还原成金属钛,该反应的化学方程式为 。
(5)某同学认为:用足量B的水溶液吸收工业制硫酸尾气中的SO2,“吸收液”通过蒸发结晶制得的固体即为纯净的亚硫酸盐;取少量该固体加水溶解,再加入过量BaCl2溶液,若产生白色沉淀,即可证明得到的固体一定是纯净物。
判断该同学设想的制备和验纯方法的合理性并说明理由 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大;A是周期表中原子半径最小的元素;B元素的最高价氧化物的水化物与其简单氢化物能相互反应生成盐;C元素原子的最外层电子数是内层电子数的3倍;D元素的主族序数等于其周期数;E元素原子的最外层电子数是其电子层数的2倍。G单质是日常生活中用量最大的金属,易被腐蚀。
试回答下列问题:
(1)A元素的同位素有___________(写原子符号)
(2)实验室制取B的简单氢化物的化学反应方程式为_________________________
(3)C、D、E、F的简单离子半径由大到小的顺序是_________________(用离子符号表示)
(4)用化学事实说名E与F这两种元素非金属性的强弱_____________________(举一例)
(5)下列有关G的说法不正确的是_______
A、铁位于第四周期ⅧB族,在人体内的血红蛋白中含有铁元素
B、过量的铁分别与氯气和稀盐酸反应所得氯化物相同
C、FeCl3、FeCl2、Fe(OH)3都可以通过化合反应制取
D、氢氧化铁与HI溶液仅发生中和反应
(6)向NaOH溶液中通入一定量的F单质,两者恰好完全反应,生成物中有三种含F的离子,其中两种离子的物质的量与反应时间的曲线如图所示。请写出t2时反应的总的化学方程式 _____________________ 。
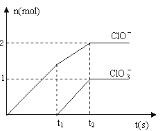
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车的启动电源常用铅蓄电池。其结构如下图所示,放电时的电池反应如下:PbO2+Pb+2H2SO4===2PbSO4+2H2O根据此反应判断下列叙述中正确的是( )

A. PbO2是电池的负极
B. SO42-向Pb极移动
C. PbO2得电子,被氧化
D. 电池放电时,溶液酸性增强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com