
【题目】位于前四周期的6种主族元素A、B、C、D、E、F原子序数依次增大,其中B、D同主族, D、E同周期。A、B、C在周期表中相邻,且三种元素的原子最外层电子数之和为18。F是其所在周期中最活泼的金属元素。根据推断回答下列问题:
(1)A在周期表中的位置_____;写出A单质的电子式________。
(2)用“>”或“<”填空:
离子半径 | 非金属性 | 酸性 | 氢化物的稳定性 |
F+_D2— | A_B | D的最高价氧化物的水化物___E的最高价氧化物的水化物 | C的氢化物__E的氢化物 |
(3)—定条件,在水溶液中1molE-、![]() (x=1,2,3,4)的能量(KJ)相对大小如图所示。
(x=1,2,3,4)的能量(KJ)相对大小如图所示。
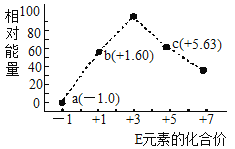
①c点对应的微粒是_______(填离子符号)。
②b→a+c反应的离子方程式为________,该反应是______反应(填“吸热”或“放热”)。
【答案】第二周期VA族 ![]() < < < >
< < < > ![]() 3C1O-=
3C1O-=![]() +2Cl- 放热
+2Cl- 放热
【解析】
A、B、C在周期表中相邻,且三种元素的原子最外层电子数之和为18,应为同周期相邻元素,且分别位于周期表第VA、ⅥA、ⅦA元素,应分别为N、O、F元素,B、D同主族则D为S元素,D、E同周期则E为Cl元素,F是其所在周期中最活泼的金属元素由元素序数关系可以知道F为K元素。
(1)A为N元素,位于周期表第二周期VA族,A的单质为氮气,氮气的电子式为:![]() ,故本题答案为:第二周期VA族;
,故本题答案为:第二周期VA族;![]() ;
;
(2)K+、S2-具有相同的核外电子排布,核电荷数越大离子半径越小,则离子半径K+<S2-,同周期元素从左到右非金属性逐渐增强,则N<O,因非金属性Cl>S,则S的最高价氧化物的水化物小于Cl的最高价氧化物的水化物,非金属性F>Cl,元素的非金属性越强对应的氢化物越稳定,则HF>HCl,故本题答案为:<;<;<;>;
(3)①由图可知,c中氯元素为+5价,则d为ClO3-,故本题正确答案为:ClO3-;
②结合氯元素的化合价可以知道,b→a+c反应为3ClO-=ClO3-+2Cl-,生成1mol c时的能量变化为3×60kJ-63kJ-0=117kJ,反应物总能量大于生成物总能量,该反应放出117kJ热量,因此,本题正确答案为:3ClO-=ClO3-+2Cl-;放热。


科目:高中化学 来源: 题型:
【题目】下列化学用语对事实的解释不正确的是
A.NaHS水溶液显碱性:HS-+H2OS2-+H3O+
B.苯酚能溶于Na2CO3溶液:C6H5OH+CO32-=C6H5O-+HCO3-
C.三元催化剂净化汽车尾气中的NO和CO:2NO+2CO![]() 2CO2+N2
2CO2+N2
D.铜矿淋溶液(CuSO4)遇方铅矿(PbS)发生沉积:Cu2++SO42-+PbS=CuS+PbSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组探究KI与Cu(NO3)2的反应,进行实验一:
实验一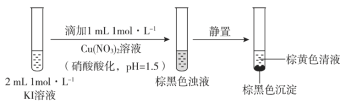
注:本实验忽略Cu2+在此条件下的水解。
(1)取棕黄色清液,加入少量______溶液(试剂a),清液变为______色,说明生成了I2。
(2)探究生成I2的原因。
①甲同学进行如下实验:向2mL1mol·L-1KI溶液中加入1mL______溶液(硝酸酸化,pH=1.5),再加入少量试剂a,观察到与(1)相同的现象。甲同学由此得出结论:实验一中生成I2的原因是酸性条件下,![]() 氧化了I-。
氧化了I-。
②乙同学认为仅由甲的实验还不能得出相应结论。他的理由是该实验没有排除____________氧化I-的可能性。
③若要确证实验一中是![]() 氧化了I-,应在实验一的基础上进行检验______的实验。
氧化了I-,应在实验一的基础上进行检验______的实验。
(3)探究棕黑色沉淀的组成。
①查阅资料得知:CuI为难溶于水的白色固体。于是对棕黑色沉淀的组成提出两种假设:
a.CuI吸附I2b._________吸附I2。为证明上述假设是否成立,取棕黑色沉淀进行实验二:
实验二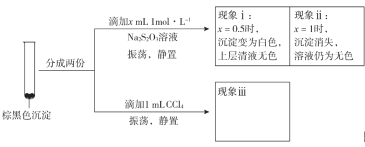
已知:CuI难溶于CCl4;I2+![]() ==2I-+
==2I-+![]() (无色);Cu++S2O32-==
(无色);Cu++S2O32-==![]() (无色)。由实验二得出结论:棕黑色沉淀是CuI吸附I2形成的。
(无色)。由实验二得出结论:棕黑色沉淀是CuI吸附I2形成的。
②现象iii为______________。
③用化学平衡移动原理解释产生现象ii的原因:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤素单质在碱性溶液中容易发生歧化反应,歧化的产物依反应温度的不同而不同。
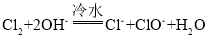 、
、![]()
下图为制取氯气、氯酸钾、次氯酸钠和检验氯气性质的微型实验装置:
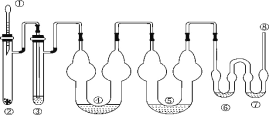
装置中盛装的药品如下:
①胶头滴管中装有 5 mL 浓盐酸;②微型具支试管中装有 1.5 g KMnO4;③微型具支试管中装有 2~3 mL 浓硫酸;④U 形反应管中装有 30% KOH 溶液;⑤U 形反应管中装有 2 mol·L-1 NaOH 溶液;⑥、⑦双 U 形反应管中分别装有 0.1 mol·L-1 KI-淀粉溶液和 KBr 溶液;⑧尾气出口用浸有 0.5 mol·L-1 Na2S2O3 溶液的棉花轻轻覆盖住
(1)检查整套装置气密性的方法是_________。
(2)为了使装置④⑤中的反应顺利完成,应该控制的反应条件分别为_______、_______。
(3)装置⑥⑦中能够观察到的实验现象分别是_________, _______。
(4)如果把装置⑥⑦中的试剂互换位置,则______(填“能”或“不能”)证明氧化性 Cl2>I2,理由是________。
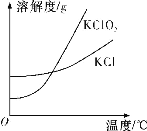
(5)已知氯酸钾和氯化钾的溶解度曲线如图所示,反应结束后,从装置④所得溶液中提取氯酸钾晶体的实验操作是________。
(6)尾气处理时 Cl2 发生反应的离子方程式为_________。
(7)选择微型实验装置的优点有____________(任答两点)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)烃A在同温、同压下蒸气的密度是H2的35倍,其分子式为________。
(2)3—甲基—1一丁炔的结构简式为________
(3)![]() 的分子式为__________
的分子式为__________
(4)分子式为C8H10属于芳香烃的同分异构体共有______种,其中_______(结构简式)在苯环上的一氯取代产物有两种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图,回答问题。
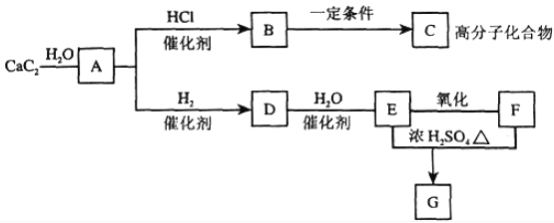
(1)有机物C的结构简式:________。
(2)①反应DE的化学方程式是_____________。
②E和F反应生成G的化学方程式是__________,反应类型为_________。
③实验室制取A的化学方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应A2+B2 = 2AB的能量变化如图所示,则下列说法正确的是
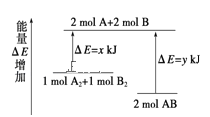
A.该反应是吸热反应
B.断裂 1molA-A 键和 1molB-B 键能放出xkJ 的能量
C.2mol AB 的总能量高于1mol A2和1mol B2和的总能量
D.断裂 2mol A-B 键需要吸收ykJ 的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铂、钴、镍及其化合物在工业和医药等领域有重要应用。回答下列问题:
(1)筑波材料科学国家实验室科研小组发现了在5K下呈现超导性的晶体CoO2,该晶体具有层状结构。
①晶体中原子Co与O的配位数之比为_________。
②基态钴原子的价电子排布图为_______。
(2)配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂。固态Ni(CO)4属于_____晶体;写出两种与CO具有相同空间构型和键合形式的分子或离子:_______。
(3)某镍配合物结构如图所示:
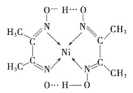
①分子内含有的化学键有___________(填序号).
A 氢键 B 离子键 C 共价键 D 金属键 E 配位键
②配合物中C、N、O三种元素原子的第一电离能由大到小的顺序是N> O>C,试从原子结构解释为什么同周期元素原子的第一电离能N>O_________。
(4)某研究小组将平面型的铂配合物分子进行层状堆砌,使每个分子中的铂原子在某一方向上排列成行,构成能导电的“分子金属" ,其结构如图所示。

①"分子金属"可以导电,是因为______能沿着其中的金属原子链流动。
②"分子金属"中,铂原子是否以sp3的方式杂化?_________(填“是"或“否"),其理由是__________。
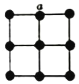
(5)金属铂晶体中,铂原子的配位数为12,其立方晶胞沿x、y或z轴的投影图如图所示,若金属铂的密度为d g·cm-3,则晶胞参数a=_______nm(列计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(乙酸锰可用于制造钠离子电池的负极材料。可用如下反应制得乙酸锰:4Mn(NO3)26H2O+26(CH3CO)2O=4(CH3COO)3Mn+8HNO2+3O2↑+40CH3COOH
(1)Mn3+基态核外电子排布式为___。
(2)NO3-中氮原子轨道的杂化类型是___。
(3)与HNO2互为等电子体的一种阴离子的化学式为___。
(4)配合物[Mn(CH3OH)6]2+中配位原子是___。
(5)CH3COOH能与H2O任意比混溶的原因,除它们都是极性分子外还有___。
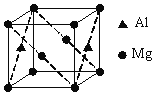
(6)镁铝合金经过高温淬火获得一种储钠材料,其晶胞为立方结构(如图所示),图中原子位于顶点或面心。该晶体中每个铝原子周围距离最近的镁原子数目为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com