
Ca(HCO3)2![]() CaCO3↓+CO2↑+H2O,
CaCO3↓+CO2↑+H2O,
Mg(HCO3)2![]() MgCO3↓+CO2↑+H2O
MgCO3↓+CO2↑+H2O
MgCO3+H2O![]() Mg(OH)2+CO2↑
Mg(OH)2+CO2↑
某学生为研究水垢的成分,取一定量水垢经加热使其失去结晶水并干燥后称得质量为
(1)通过计算确定水垢中是否含有碳酸镁。
(2)残留固体经冷却后称得质量为
解:(1)n(![]() )=n(CO2)=n(BaCO3)=
)=n(CO2)=n(BaCO3)=![]() =0.12 mol
=0.12 mol
若水垢中不含MgCO3,则
m(CaCO3)=0.12 mol×
故一定含有MgCO3
(2)m(H2O)=
n(H2O)=0.02 mol n〔Mg(OH)2〕=0.02 mol
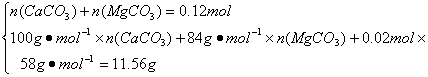
n(CaCO3)=0.02 mol n(MgCO3)=0.1 mol
解析:(1)n(![]() )=n(CO2)=n(BaCO3)=
)=n(CO2)=n(BaCO3)=![]() =0.12 mol。
=0.12 mol。
若水垢中不含MgCO3,则全部为CaCO3。
m(CaCO3)=0.12 mol×
故一定含有MgCO3。
(2)m(H2O)=
n(H2O)=![]() =0.02 mol
=0.02 mol
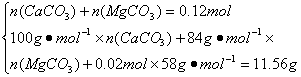 所以
所以


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
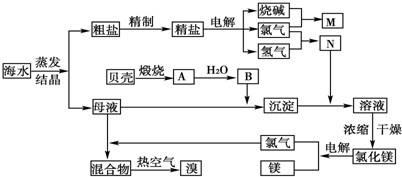
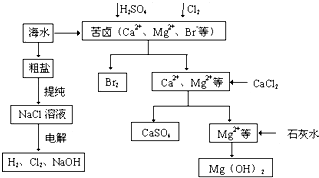 工业上对海水资源综合开发利用的部分工艺流程如图所示.
工业上对海水资源综合开发利用的部分工艺流程如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、粗盐提纯的过程中,操作步骤有溶解、过滤、蒸发 | B、粗盐中除Na+、Cl-外,通常还含有Ca2+、Mg2+、SO42- | C、用CCl4萃取溴水中的溴 | D、向试管中滴加液体时,胶头滴管紧贴试管内壁 |
查看答案和解析>>
科目:高中化学 来源: 题型:
2- 4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com