
| A、配制一定物质的量浓度的溶液时,定容后把容量瓶倒转摇匀,发现液面低于刻度,再补充几滴水到刻度 |
| B、锥形瓶盛装待测液前需先用蒸馏水洗净,再用待测液润洗 |
| C、石蕊试纸在测定气体酸碱性时必须用蒸馏水润湿 |
| D、向稀氢氧化钠溶液中滴加饱和氯化铁溶液并不断搅拌,制取氢氧化铁胶体 |


科目:高中化学 来源: 题型:
| A、氢氧化钠溶液吸收过量的二氧化碳 OH-+CO2=HCO3- |
| B、亚硫酸氢铵溶液与足量氢氧化钠溶液反应 HSO3-+OH-=SO32-+H2O |
| C、氯气通入冷水中 Cl2+H2O=Cl-+ClO-+2H+ |
| D、碳酸钙固体加醋酸 CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | X | W | Y | Z | Q |
| 原子半径(×10-12m) | 37 | 64 | 66 | 70 | 154 |
| 主要化合价 | +1 | -1 | -2 | +5、-3 | +1 |
| A、由Q与Y形成的化合物中只存在离子键 |
| B、Z与X之间形成的化合物具有还原性 |
| C、由X、Y、Z三种元素形成的化合物,其晶体一定是分子晶体 |
| D、Y与W形成的化合物中,Y显负价 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4L HF中含有的氟原子数目为NA(NA表示阿伏加德罗常数) |
| B、0.1mol/L的NH4HSO4溶液中滴加0.1mol/L的Ba(OH)2溶液至沉淀刚好完全:c(NH4+)>c(OH-)>c(SO42-)>c(H+) |
C、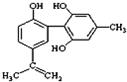 1mol如图所示物质与浓溴水反应时通常最多消耗Br2为4mol |
| D、常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的△H>0,一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
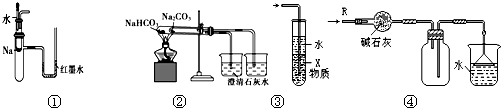
| A、装置①可用于验证Na与H2O反应是否放热 |
| B、装置②可用于比较Na2CO3与NaHCO3的稳定性 |
| C、装置③中X若为CCl4,可用于吸收NH3或HCl,并防止倒吸 |
| D、装置④可用于干燥、收集NH3,并吸收多余的NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铝片与NaOH溶液反应:2OH-+Al═AlO2-+H2↑ |
| B、向AgCl悬浊液中滴加NaI溶液,白色沉淀变成黄色:AgCl+I-═AgI+Cl- |
| C、用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O═3I2+6OH- |
| D、将磁性氧化铁溶于盐酸:Fe3O4+8H+═3Fe3++4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 成分 | CaO | P2O5 | SO3 | CO2 |
| 质量分数(%) | 47.30 | 28.40 | 3.50 | 6.10 |
| n[H3PO4] |
| n[Ca(H2PO4)]2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
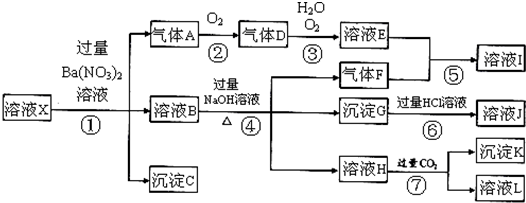
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、已知甲烷的燃烧热为890.3 kJ?mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═2CO2(g)+2H2O(g)△H=-890.3 kJ?mol-1 |
| B、已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定 |
| C、已知中和热为△H=-57.4 kJ?mol-1,则1mol稀硫酸和足量稀NaOH溶液反应的反应热就是中和热 |
| D、已知S(g)+O2(g)═SO2(g)△H1; S(s)+O2(g)═SO2(g)△H2,则△H1<△H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com