
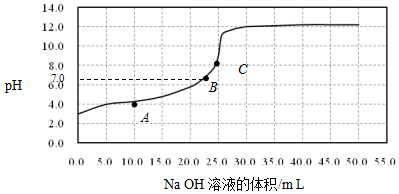
| A. | 在A点:c(HX)>c(Na+)>c(X-) | |
| B. | 在B点,溶液中c(H+)=c(OH-) | |
| C. | C点溶液中存在的主要平衡是X-+H2O?HX+OH- | |
| D. | 0.05mol/L NaX溶液的pH≈9 |
分析 A.在A点,显酸性,碱不足,结合电荷守恒判断;
B.在B点,pH=7,显中性;
C.C点,酸碱刚好完全反应,则溶液中的溶质为NaX;
D.C点,酸碱刚好完全反应,则溶液中的溶质为NaX.
解答 解:A.在A点,显酸性,碱不足,则溶液中的溶质为HX和NaX,结合电荷守恒可知c(HX)>c(X-)>c(Na+)>c(H+)>c(OH-),故A错误;
B.在B点,pH=7,显中性,则溶液中c(H+)=c(OH-),故B正确;
C.C点,酸碱刚好完全反应,则溶液中的溶质为NaX,又显碱性,则存在水解平衡X-+H2O?HX+OH-,故C正确;
D.C点,酸碱刚好完全反应,则溶液中的溶质为NaX,又溶液的总体积为50.00mL,所以NaX的浓度为0.05mol/L,即由图可知pH≈9,故D正确;
故选A.
点评 本题考查酸碱混合溶液中的定性判断,明确图中各点发生的化学反应及溶液中的溶质是解答本题的关键,题目难度中等.


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 在坩埚中放入NaCl溶液,加热、蒸发得到NaCl晶体 | |
| B. | 用10 mL的量筒量取4.8 mL的盐酸 | |
| C. | 用托盘天平称取25.20 g NaCl | |
| D. | 用1000 mL容量瓶配制450 mL 0.1 mol•L-1的盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.125mol/L | B. | 0.175 mol/L | C. | 0.25 mol/L | D. | 0.50 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
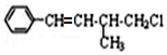 下列叙述不正确的是( )
下列叙述不正确的是( )| A. | 1mol 该有机物在加热和催化剂作用下,最多能和4 mol H2反应 | |
| B. | 该有机物分子式为C11H13Cl | |
| C. | 该有机物能通过加成、消去、水解三步反应生成: | |
| D. | 该有机物遇硝酸银溶液不能产生白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇是重要的化学工业基础原料和清洁液体燃料,工业上常利用CO来制备甲醇.
甲醇是重要的化学工业基础原料和清洁液体燃料,工业上常利用CO来制备甲醇.| 容器编号 | 容器体积/L | 温度/K | CO物质的量/mol | H2物质的量/mol | CH3OH物质的量/mol | 平衡时CO浓度/mol•L-1 | 平衡常数K |
| 1 | 1.0 | 500 | 0.2 | 0.2 | 0 | 0.12 | K1 |
| 2 | 1.0 | 800 | 0.1 | 0 | 0.1 | 0.16 | K2 |
| 3 | 2.0 | 800 | 0.2 | 0.2 | 0 | X | K3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 序号 | 实验操作 | 实验现象 |
| 1 | 取0.3g 纯净Na2SO3固体,向其中加入10mL 2mol•L-1 盐酸,再滴入4滴BaCl2溶液 | 产生无色气泡;滴入BaCl2溶液后,开始无现象,4min后,溶液变浑浊 |
| 2 | 取0.3g 纯净Na2SO3固体,向其中加入10mL 2mol•L-1 HNO3,再滴入4滴BaCl2溶液 | 产生无色气泡;滴入BaCl2溶液后,开始无现象,2h后,溶液变浑浊 |
| 3 | 取0.3g 纯净Na2SO3固体,向其中加入10mL 浓HNO3,再滴入4滴BaCl2溶液 | 产生红棕色气体;滴入BaCl2溶液后,溶液立即产生大量白色沉淀 |
| 序号 | 实验操作 | 实验现象 |
| 4 | 取0.3g纯净Na2SO3和1.17gNaCl固体混合物,向其中加入10mL 2mol•L-1 HNO3,再滴入4滴BaCl2溶液 | 产生无色气泡;滴入BaCl2溶液后,开始无现象,20min后,溶液变浑浊 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 放电时,正极区的pH增大 | |
| B. | 放电时,负极的电极反应式为PbO4+4H++2e-═Pb2++2H2O | |
| C. | 充电时,铅电极与电源的正极相连 | |
| D. | 充电时,当阴极生成20.7g Pb时溶液中有0.2mol电子通过 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | b g | B. | $\frac{3b}{4}$g | C. | $\frac{b}{2}$g | D. | $\frac{b}{4}$g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com