
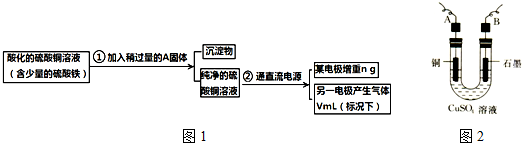
分析 (1)铁离子水解,调节pH可使铁离子转化为沉淀而除去;
(2)电解发生2Cu2++2H20$\frac{\underline{\;电解\;}}{\;}$2Cu+4H++02↑,以此分析现象;
(3)根据电极上析出铜的质量以及电极上产生气体的体积来测定铜的相对原子质量,则需要称量电解前后电极的质量;
(4)根据电子守恒可知,2Cu~02↑,以此计算.
解答 解:(1)铁离子水解,调节pH可使铁离子转化为沉淀而除去,且不能引入杂质,故可以加入CuO或Cu(OH)2或CuCO3,故答案为:CuO或Cu(OH)2或CuCO3,调节pH为4-5使铁离子转化为沉淀而除去;
(2)电解发生2Cu2++2H20$\frac{\underline{\;电解\;}}{\;}$2Cu+4H++02↑,观察到铜棒变粗,石墨极上有气泡生成,溶液的颜色变浅,
故答案为:铜棒变粗,石墨极上有气泡生成,溶液的颜色变浅;2Cu2++2H20$\frac{\underline{\;电解\;}}{\;}$2Cu+4H++02↑;
(3)根据电极上析出铜的质量以及电极上产生气体的体积来测定铜的相对原子质量,则需要称量电解前后电极的质量,
A.实验之前应称量电解前电极的质量,故A正确
B.电解后,电极在烘干称重前,必须用蒸馏水冲洗,减少误差,故B正确;
C.刮下电解后电极上析出的铜,并清洗、称重,操作不精确,难得到准确的Cu的质量,故C错误;
D.电极在烘干称重的操作中必须按“烘干-称重-再烘干-再称重”进行,防止Cu被氧化,故D正确;
E.在有空气存在的情况下,烘干电极必须采用低温烘干的方法,防止Cu被氧化,故E正确;
故答案为:ABDE;
(5)设Cu的相对原子质量为x,
根据电子守恒可知,2Cu~02↑,则
2x 1
ng $\frac{V×1{0}^{-3}L}{22.4L/mol}$
则有:2x×$\frac{V×1{0}^{-3}L}{22.4L/mol}$=n,
解得x=$\frac{11200n}{V}$,故答案为:$\frac{11200n}{V}$.
点评 本题考查实验方案的设计,涉及电解原理及相对原子质量的测定,注意电解中电子守恒即可解答,(4)为解答的易错点,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 3.4gNH3中含有电子数为2NA | |
| B. | 0.1mol/L CuSO4溶液中含有的SO2-4数目为0.1NA | |
| C. | 常温常压下,2.24L O3中含有的氧原子数为0.3NA | |
| D. | 8.7gMnO2与50mL 8mol/L浓盐酸充分反应后,生成Cl2的氯分子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
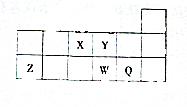 短周期元素X、Y、Z、W、Q在元素周期表中相对位置如图所示
短周期元素X、Y、Z、W、Q在元素周期表中相对位置如图所示 ,其水溶液呈碱性性(填酸、碱或中)
,其水溶液呈碱性性(填酸、碱或中)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{ρ}{400}$mol•L-1 | B. | $\frac{20}{ρ}$mol•L-1 | C. | $\frac{50ρ}{41}$mol•L-1 | D. | $\frac{25ρ}{41}$mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制取二氧化氮时,用水或NaOH溶液吸收尾气 | |
| B. | 用将Fe(NO3)2样品溶于稀硫酸后,滴加KSCN溶液,观察溶液是否变红的方法来检验Fe(NO3)2晶体是否变质 | |
| C. | 锥形瓶可用作加热的反应器 | |
| D. | 只滴加氨水可以鉴别出NaCl、AlCl3、Na2SO4、MgCl2四种溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用露天焚烧方法处理塑料废弃物 | |
| B. | 利用高纯单质硅制成太阳能电池 | |
| C. | 利用微生物发酵技术,将植物秸秆、动物粪便等制成沼气 | |
| D. | 利用二氧化碳等原料合成聚碳酸酯类可降解塑料代替聚乙烯塑料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 三氯氧磷(POCl3)常温下为无色液体,有广泛应用.近年来三氯氧磷的工业生产由三氯化磷的“氧气直接氧化法”代替传统的三氯化磷“氯化水解法”(由氯气、三氯化磷和水为原料反应得到).
三氯氧磷(POCl3)常温下为无色液体,有广泛应用.近年来三氯氧磷的工业生产由三氯化磷的“氧气直接氧化法”代替传统的三氯化磷“氯化水解法”(由氯气、三氯化磷和水为原料反应得到).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
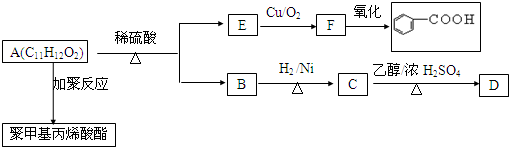
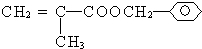 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
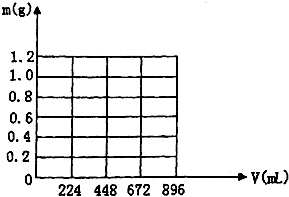 将KOH和Ca(OH)2混合物1.86g全部溶于一定量水中形成稀溶液,再缓缓通入足量的CO2气体.当生成沉淀的质量刚好最大时,消耗CO2的体积为224mL(标准状况,忽略CO2溶于水情况,以下情况相同.)
将KOH和Ca(OH)2混合物1.86g全部溶于一定量水中形成稀溶液,再缓缓通入足量的CO2气体.当生成沉淀的质量刚好最大时,消耗CO2的体积为224mL(标准状况,忽略CO2溶于水情况,以下情况相同.)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com