
【题目】钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的1/10。
(1)钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的电极反应式。
正极:_____________________;负极:____________________。
(2)为了降低某水库的铁闸门被腐蚀的速率,可以采用下图所示甲的方案,其中焊接在铁闸门的固体材料R可以采用_______________。
A.铜 B.钠 C.锌 D.石墨

(3)上图中乙方案也可降低铁闸门腐蚀速率,其中铁闸门应该连接在直流电源的_____________极。
(4)除了以上金属防护的方法外,请再例举两种办法:___________;___________。
【答案】O2+4e-+2H2O=4OH- 2Fe-4e- = 2Fe2+ C 负 改变金属组成或内部结构 在金属的表面覆盖保护层(其它合理答案也可以)
【解析】
如图甲所示,铁闸门-金属R-海水构成原电池,铁做正极得到保护,所以属于原电池原理。如图乙所示,铁闸门与电源负极相连,作阴极,得到保护,该装置称为外加电流的阴极保护法。
(1)钢铁发生吸氧腐蚀,负极上Fe失电子发生氧化反应,电极反应式为Fe-2e-=Fe2+,正极上氧气得电子发生还原反应,电极反应式为O2+2H2O+4e-=4OH-。
(2)作原电池负极的金属加速被腐蚀,作原电池正极的金属被保护,根据图知,该装置是利用原电池原理保护Fe,所以应该选取比Fe活泼的金属,如锌。不能选择钠,钠太活泼,直接和水发生反应。
(3)作电解池阳极的金属加速被腐蚀,作电解池阴极的金属被保护,根据图知,该装置是利用电解池原理保护Fe,则铁作电解池阴极,应该连接电源负极,故答案为:负。
(4)金属防护的方法还有在金属的表面覆盖保护层、改变金属内部结构等方法。


 互动英语系列答案
互动英语系列答案科目:高中化学 来源: 题型:
【题目】由W、X、Y、Z四种金属按下列装置进行实验。下列说法不正确的是
甲 | 乙 | 丙 | |
装置 |
|
|
|
现象 | 金属W不断溶解 | Y 的质量增加 | W上有气体产生 |
A.装置甲中W作原电池负极
B.装置乙中Y电极上的反应式为Cu2++2e=Cu
C.装置丙中溶液的c(H+)不变
D.四种金属的活动性强弱顺序为Z>W>X>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为组成人体细胞的主要的元素及其比例。下列相关叙述中,错误的是( )
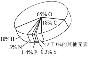
A.图中所示为细胞鲜重中主要的元素的所占比例
B.因为 O 的含量最多,所以 O 是构成有机物的最基本元素
C.细胞失去大部分水分后,C 的所占比例最大
D.图中所示的元素在非生物界也可以找到
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下联氨(N2H4)的水溶液中有:
①N2H4+H2O![]() N2H5++OH- K1
N2H5++OH- K1
②N2H5++H2O![]() N2H62++OH- K2
N2H62++OH- K2
(提示:二元弱碱的电离也是分步电离)
该溶液中的微粒的物质的量分数δ(X)随-lgc(OH-)变化的关系如图所示。下列叙述错误的是( )

A.据A点可求:K1=10-6
B.D点溶液的c(OH-)=10-l1
C.若C点为N2H5Cl溶液,则存在:c(Cl-)>c(N2H5+)+2c(N2H62+)
D.在N2H5Cl水溶液中,c(N2H4)+c(OH-)=2c(N2H62+)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温常压下,取下列四种有机物各1mol,分别在足量的氧气中燃烧,消耗氧气最多的是
A. C2H5OH B. CH4 C. C2H4O D. C3H8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知FeSO4·7H2O晶体在加热条件下发生如下反应:2FeSO4·7H2O![]() Fe2O3+SO2↑+SO3↑+14H2O↑;如图的装置可用来检验上述反应中所有的气体产物,请回答下列问题:
Fe2O3+SO2↑+SO3↑+14H2O↑;如图的装置可用来检验上述反应中所有的气体产物,请回答下列问题:
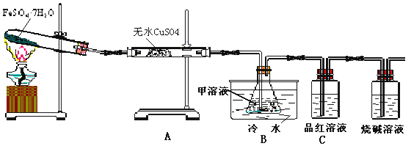
(1)用于检验SO2气体的装置是______(填装置的字母),确认水蒸气存在的现象是______;
(2)利用装置B可以确认的产物是______,装置B中的甲溶液可选(填序号)______。
①足量澄清石灰水②足量氯化钡溶液③足量硝酸钡溶液
该装置中冷水的作用是______;
(3)为探究Fe2O3的性质和用途,取试管中少许固体溶于适量盐酸中制备饱和铁盐溶液,将此饱和溶液逐滴加入沸水中加热片刻,观察液体的颜色变为______,检验该分散系最简方法的操作为______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2L密闭容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据

(1)该反应的化学方程式为______________。
(2)反应开始至2min,用Z表示的平均反应速率为_________。
(3)下列叙述能说明上述反应达到化学平衡状态的是________(填序号)
A.混合气体的总物质的量不随时间的变化而变化
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗![]() X,同时生成
X,同时生成![]() Z
Z
D.混合气体的总质量不随时间的变化而变化
E.混合气体的密度不再发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向溴水中加入足量乙醛溶液,可以看到溴水褪色。据此对溴水与乙醛发生的有机反应类型进行如下探究,请你完成下列填空:
Ⅰ.猜测:
(1)溴水与乙醛发生取代反应;
(2)溴水与乙醛发生加成反应;
(3)溴水与乙醛发生___反应。
Ⅱ.设计方案并论证:
为探究哪一种猜测正确,某研究性学习小组提出了如下两种实验方案:
方案1:检验褪色后溶液的酸碱性。
方案2:测定反应前用于溴水制备的Br2的物质的量和反应后Br-离子的物质的量。
(1)方案1是否可行?___?理由是___。
(2)假设测得反应前用于溴水制备的Br2的物质的量为amol,
若测得反应后n(Br-)=___mol,则说明溴水与乙醛发生加成反应;
若测得反应后n(Br-)=___mol,则说明溴水与乙醛发生取代反应;
若测得反应后n(Br-)=___mol,则说明猜测(3)正确。
Ⅲ.实验验证:某同学在含0.005molBr2的10mL溶液中,加入足量乙醛溶液使其褪色;再加入过量AgNO3溶液,得到淡黄色沉淀1.88g(已知反应生成有机物与AgNO3不反应)。根据计算结果,推知溴水与乙醛反应的离子方程式为___。
Ⅳ.拓展:
请你设计对照实验,探究乙醛和乙醇的还原性强弱(填写下表)。
实验操作步骤 | 实验现象 | 结论 |
___ | ___ | ___ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com