
| 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 | |
| 第一组 | Na2CO3 | H2SO4 | NaHCO3 | CaO | CO2 |
| 第二组 | NaOH | HCl | NaCl | Na2O | CO |
| 第三组 | NaOH | CH3COOH | CaF2 | Al2O3 | SO2 |
| 物质 | M | N | Q | P |
| 反应前质量(g) | 50 | 1 | 3 | 12 |
| 反应后质量(g) | X | 26 | 3 | 30 |
分析 (1)第一组中碳酸钠不是碱;第二组中一氧化碳不是酸性氧化物;第三组中氧化铝为两性氧化物;
(2)根据三类分散系的本质差异是分散质粒子的大小分析;胶体具有丁达尔效应,据此可鉴别胶体和溶液;
(3)①消耗1mol过氧化钠可以生成0.5mol氧气,然后根据m=nM计算出生成氧气的质量;
②根据n=$\frac{m}{M}$计算出碳酸氢钠的物质的量,再根据方程式及V=nVm计算出生成标况下二氧化碳的体积;
③氯气与水的反应中,消耗1mol氯气转移了1mol电子;
(4)该反应中Q的质量不变,则Q为催化剂;根据质量守恒定律计算出X,然后根据质量变化判断反应物、生成物,从而得出该反应的反应类型.
解答 解:(1)第一组中Na2CO3的说明是纯碱,但它属于正盐,不是碱;
第二组中CO不能与碱溶液反,则CO不属于酸性氧化物;
第三组中Al2O3能够与酸和强碱溶液反应,属于两性氧化物,不属于碱性氧化物,
故答案为:Na2CO3;CO;Al2O3;
(2)当分散剂是水或其它溶液时,根据分散质粒子直径大小来分类,把分散系划分为:溶液(小于1nm)、胶体(1nm~100nm)、浊液(大于100nm),所以溶液、胶体和浊液这三种分散系的本质的区别在于分散质粒子直径大小;胶体具有丁达尔现象,而溶液不具有,据此可鉴别溶液和胶体,
故答案为:分散质微粒直径大小;丁达尔;
(3)①2Na2O2+2H2O═4NaOH+O2↑反应中,每消耗1mol Na2O2生成会生成0.5mol氧气,生成氧气的质量为:32g/mol×0.5mol=16g,
故答案为:16;
②2NaHCO3═Na2CO3+H2O+CO2↑反应中,168g NaHCO3的物质的量为:$\frac{168g}{84g/mol}$=2mol,根据反应可知,消耗2mol碳酸氢钠会生成1mol二氧化碳,标况下1mol二氧化碳的体积为:22.4L/mol×1mol=22.4L,
故答案为:22/4;
③Cl2+H2O═HCl+HClO反应中,氯气既是氧化剂也是还原剂,标况下22.4L Cl2的物质的量为:$\frac{22.4L}{22.4L/mol}$=1mol,消耗1mol氯气转移了1mol电子,
故答案为:1;
(4)根据表中数据可知,Q在反应前后的质量不变,则Q在反应中作催化剂;
根据质量守恒可知:X+26+3+30=50+1+3+12,解得:X=7,反应中M的质量减小,Q、P的质量增加,则该反应为M分解生成Q和P的反应,属于分解反应,
故答案为:分解;催化剂.
点评 本题考查了物质的量的计算、酸碱盐及氧化物的概念与判断、分散系类型及判断、化学反应类型的判断等知识,题目难度中等,试题知识点较多,充分考查学生的分析、理解能力及灵活应用能力.


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:选择题
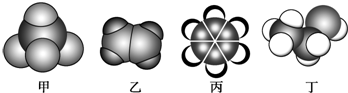
| A. | 甲能使酸性高锰酸钾溶液褪色 | |
| B. | 乙可与溴水发生加成反应使溴水褪色 | |
| C. | 丙与溴水可以发生取代反应 | |
| D. | 丁在稀硫酸作用下可与乙酸发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 乙酸是白醋中的主要成分.
乙酸是白醋中的主要成分.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使酚酞变红色的溶液:Na+、Cu2+、HCO3-、NO3- | |
| B. | 0.1mol.L-1AgNO3溶液:H+、K+、SO42-、Cl- | |
| C. | 强酸性溶液:Mg2+、K+、SO42-、NO3- | |
| D. | 0.1mol.L-1NaAlO2溶液:NH4+、Na+、OH-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
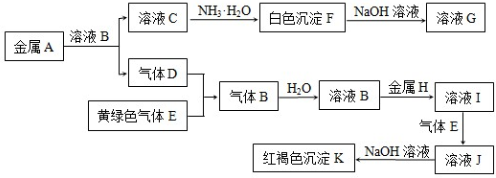
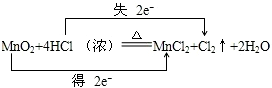 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯与环丙烷(C3H6)互为同系物 | |
| B. | 乙烯和聚乙烯均能和溴水发生加成反应而使溴水褪色 | |
| C. | 皮肤沾上浓HNO3变成黄色,立即用饱和NaOH溶液冲洗 | |
| D. | 丙酸、乙酸甲酯和2-羟基丙醛(CH3CHOHCHO)互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
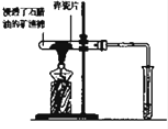
| A. | 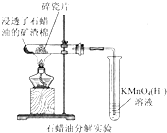 探究石蜡油分解的产物中含有不饱和烃 | |
| B. | 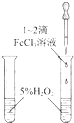 探究催化剂对化学反应速率的影响 | |
| C. |  验证酸性:CH3COOH>H2CO3>H2SiO3 | |
| D. | 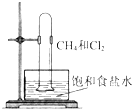 验证甲烷和氯气能发生反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com