

分析 KAl(SO4)2溶于水,Al2O3和Fe2O3均不溶于水,混合物A加水溶解后,溶液中是KAl(SO4)2,沉淀是Al2O3和Fe2O3;
向沉淀中加NaOH溶液,Fe2O3不反应,Al2O3可与NaOH溶液反应生成NaAlO2,向NaAlO2溶液中适量盐酸可得Al(OH)3沉淀,Al(OH)3受热分解生成Al2O3;
向溶液中加过量氨水,溶液与过量氨水反应,Al3+被沉淀,得到氢氧化铝沉淀,溶液中剩余的是K2SO4、(NH4)2SO4和NH3•H2O,以此来解答.
解答 解:KAl(SO4)2溶于水,Al2O3和Fe2O3均不溶于水,混合物A加水溶解后,溶液中是KAl(SO4)2,沉淀是Al2O3和Fe2O3;
向沉淀中加NaOH溶液,Fe2O3不反应,Al2O3可与NaOH溶液反应生成NaAlO2,向NaAlO2溶液中适量盐酸可得Al(OH)3沉淀,Al(OH)3受热分解生成Al2O3;
向溶液中加过量氨水,溶液与过量氨水反应,Al3+被沉淀,得到氢氧化铝沉淀,溶液中剩余的是K2SO4、(NH4)2SO4和NH3•H2O,
(1)I、II、III、IV四步中对于溶液和沉淀的分离采取的方法是过滤,故答案为:过滤;
(2)固体B为Al2O3,溶液E为K2SO4、(NH4)2SO4和NH3•H2O,故答案为:Al2O3;K2SO4、(NH4)2SO4和NH3•H2O;
(3)④为氢氧化铝的分解,反应的化学方程式为2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O,
①、②、③反应的离子方程式分别为①Al2O3+2OH-═AlO2-+H2O、②Al3++3NH3•H2O═Al(OH)3↓+3NH4+、③AlO2-+H2O+H+═Al(OH)3↓,
故答案为:2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O;Al2O3+2OH-═AlO2-+H2O;Al3++3NH3•H2O═Al(OH)3↓+3NH4+;AlO2-+H2O+H+═Al(OH)3↓.
点评 本题考查物质的分离方法及选择,为高频考点,把握物质的性质及混合物分离提纯方法等为解答的关键,侧重分析与实验能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题

 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
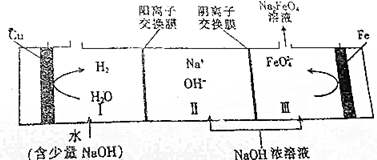
| A. | 电解时,铁棒连接电源的负极 | |
| B. | 铁棒的电极反应式为Fe+6e-+8OH-═FeO42-+4H2O | |
| C. | 若Ⅲ区生成1mol Na2FeO4,Ⅰ区将生成67.2L H2 | |
| D. | 电解总反应的离子方程式为Fe+2OH-+2H2O$\frac{\underline{\;电解\;}}{\;}$FeO42-+3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 导电性强的溶液一定是强电解质溶液 | |
| B. | NaCl晶体由Na+和Cl-组成,NaCl晶体是电的良导体 | |
| C. | H2SO4是强电解质,稀硫酸中没有H2SO4分子 | |
| D. | pH=3是醋酸稀释至100倍,pH=5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,1 L pH=12的氨水溶液中含有0.01NA个NH4+ | |
| B. | 1molFeCl3与沸水反应生成胶体后,含有NA个Fe(OH)3胶粒 | |
| C. | 常温常压下,11.2L O2和O3的混合气体含有0.5NA个分子 | |
| D. | 78g Na2O2固体中含有离子总数必为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Ba(OH)2溶液中滴加稀盐酸:Ba(OH)2+2H+═Ba2++2H2O | |
| B. | 碘化钠溶液和溴水反应:I-+Br2═I2+Br- | |
| C. | 碳酸钙溶于醋酸中:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | 实验室用浓盐酸和MnO2制Cl2:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+Mn2++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 降低温度可以加快反应速率 | |
| B. | 向容器中再加入N2可以加快反应速率 | |
| C. | 达到化学反应限度时,生成2 mol NH3 | |
| D. | 达到化学平衡时 N2、H2、NH3的物质的量之比为1:3:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com