

| 名称 | 分子量 | 性状 | 密度g/cm3 | 熔点℃ | 沸点℃ | 溶解度:克/100mL溶剂 | ||
| 水 | 醇 | 醚 | ||||||
| 苯甲醛 | 106 | 无色液体 | 1.06 | -26 | 178 | 0.3 | 互溶 | 互溶 |
| 乙酸酐 | 102 | 无色液体 | 1.082 | -73 | 138 | 12 | 溶 | 不溶 |
| 肉桂酸 | 148 | 无色固体 | 1.248 | 133 | 300 | 0.04 | 24 | 溶 |

分析 依据步骤分析可知,
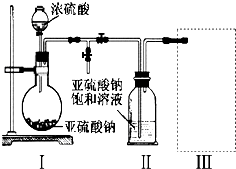
Ⅰ合成:按图甲连接仪器,加入5mL苯甲醛、14mL乙酸酐和7.0g无水碳酸钾.再加入几粒固体X,控制温度在140~170℃,将此混合物回流45min.
Ⅱ分离与提纯:
①将上述合成的产品冷却后边搅拌边加入40mL水浸泡5分钟,并用水蒸气蒸馏,从混合物中除去未反应的苯甲醛,得到粗产品
②将上述粗产品冷却后加入40mL 10%的氢氧化钠水溶液,再加90mL水,加热活性炭脱色,趁热过滤、冷却;
③将1:1的盐酸在搅拌下加入到肉桂酸盐溶液中,至溶液呈酸性,经冷却、过滤、洗涤、
干燥等操作得到较纯净的肉桂酸4.5克;
(1)三颈瓶中加入5mL苯甲醛、14mL乙酸酐和7.0g无水碳酸钾.再加入几粒固体X,是加入的沸石,目的防止液体加热暴沸;
(2)冷凝管是起到冷凝回流的作用;
(3)图乙装置中玻璃管的作用平衡压强,仪器D为锥形瓶;
(4)根据实验中为控制温度在140~170℃及选项的沸点进行判断;
(5)先根据表中密度计算出苯甲醛、乙酸酐的质量,再计算出它们的物质的量,然后理论上生成肉桂酸的质量,最后计算出肉桂酸的产率.
解答 解:(1)三颈瓶中加入5mL苯甲醛、14mL乙酸酐和7.0g无水碳酸钾.再加入几粒固体X,是加入的沸石或碎瓷片,目的防止液体加热暴沸,
故答案为:防止暴沸;沸石或碎瓷片;
(2)图甲装置中冷凝管的作用是冷凝回流,提高原料利用率,减少产物挥发,
故答案为:冷凝回流,提高原料利用率,减少产物挥发;
(3)图乙装置中玻璃管的作用是平衡压强,仪器D的名称是锥形瓶,
故答案为:平衡压强;锥形瓶;
(4)A、由于水的沸点只有100℃,不能通过水浴加热,故A错误;
B、由于甘油而的沸点高于170℃,故B正确;
C、沙子是固体,不便于控制温度,C错误;
D、由于植物油的沸点高于170℃,所以实验中为控制温度在140~170℃需在植物油中加热,故选BD;
故答案为:BD;
(5)5mL苯甲醛、14mL乙酸酐的质量分别是1.06g/ml×5ml=5.3g、14ml×1.082g/ml=15.148g,二者的物质的量分别是5.3g÷106g/mol=0.05mol、15.148g÷102g/mol=0.15mol,所以根据方程式可知,乙酸酐过量,则理论上生成肉桂酸的质量是0.05mol×148g/mol=7.4g,
所以产率是:$\frac{4.5g}{7.4g}$×100%=60.8%,
故答案为:60.8%.
点评 本题考查了有机物实验制备方法和过程分析,该题是高考中的常见题型,属于中等难度的试题.试题综合性强,侧重对学生能力的培养和训练,有利于培养学生规范严谨的实验设计、操作能力.该类试题综合性强,理论和实践的联系紧密,有的还提供一些新的信息,这就要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com