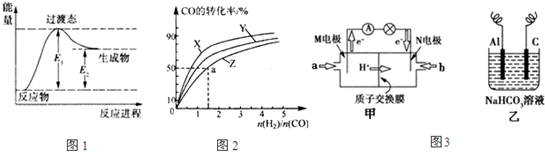
�״�ȼ�ϵ�ص�����ܶࡣ
��1�����dz��õ�һ�ּ״�ȼ�ϵ�أ����Լ״��������ķ�ӦΪԭ����Ƶģ���������Һ��KOH��Һ��д���õ�ظ����ĵ缫��Ӧʽ_______________��
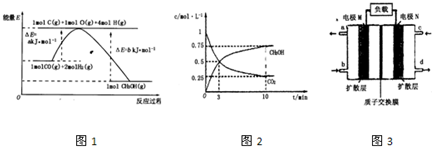
��2����ͼΪ���ñʼDZ��������ü״����ӽ���Ĥȼ�ϵ�صĽṹʾ��ͼ����װ����________���a����b����Ϊ��ص������� ��֪�κη�Ӧ������һ���Ŀ����ԡ��ü״����ӽ���Ĥȼ�ϵ����ʵ�ʹ����У�����Ӧ������������̬����ʽ�����ҷ�ӦҲ����һ�������ԣ����䷴Ӧԭ���ɱ�ʾΪ 2CH
3OH��g����3O
2��g��
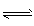
2CO
2��g����4H
2O��g������д���������·�Ӧ��ƽ�ⳣ����K��___________ �� �ڵ��Ե�ʹ�ù����У���ص��¶�������Ϊ����ԭ������ߣ����ж��¶�����ʱ�÷�Ӧ��ƽ�ⳣ����K��____________��������С�����䣩���䷴Ӧ������Ӧ���� ___________��������С�����䣩���¶�����_________�������������ڣ���ؽ���ѧ��ת��Ϊ���ܡ�
��3����֪�ڳ��³�ѹ�£�
��2CH
3OH(l)��3O
2(g)===2CO
2(g)��4H
2O(g)����H1����1 275.6 kJ��mol
��1 ��2CO(g)��O
2(g)===2CO
2(g) ��H2����566.0 kJ��mol
��1 ��H
2O(g)===H
2O(l)����H3����44.0 kJ��mol
��1 д���״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽ��__________��
II��ij�¶��£����ܱ������г���2.0 mol CO��1.0mol H
2O��������Ӧ��
CO��g��+H
2O��g��
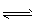
CO
2��g��+H
2��g���� CO��ת������ʱ��仯��ϵ��ͼ���ش��������⣺
��4�����һ�����淴Ӧ��ƽ�ⳣ��Kֵ�ܴ�����˵����ȷ����_________������ĸ����
A���÷�Ӧ�ķ�Ӧ���Ϻ�ܲ��ȶ�
B���÷�Ӧһ���������ں̵ܶ�ʱ�������
C���÷�Ӧ��ϵ�ﵽƽ��ʱ������һ�ַ�Ӧ��İٷֺ�����С
D���÷�Ӧһ���Ƿ��ȷ�Ӧ
E���÷�Ӧʹ�ô������岻��
��5��t2ʱ����ƽ����ϵ����ͨ��1.0 mol H2O��g����t3ʱ�����½���ƽ�⣬����ԭ����ͼ�н��ı���һ������CO��ת���ʵı仯���Ʊ�ʾ����������ע���ٴν���ƽ���CO��ת���ʡ�

 2CO2��g����4H2O��g������д���������·�Ӧ��ƽ�ⳣ����K��___________ �� �ڵ��Ե�ʹ�ù����У���ص��¶�������Ϊ����ԭ������ߣ����ж��¶�����ʱ�÷�Ӧ��ƽ�ⳣ����K��____________��������С�����䣩���䷴Ӧ������Ӧ���� ___________��������С�����䣩���¶�����_________�������������ڣ���ؽ���ѧ��ת��Ϊ���ܡ�
2CO2��g����4H2O��g������д���������·�Ӧ��ƽ�ⳣ����K��___________ �� �ڵ��Ե�ʹ�ù����У���ص��¶�������Ϊ����ԭ������ߣ����ж��¶�����ʱ�÷�Ӧ��ƽ�ⳣ����K��____________��������С�����䣩���䷴Ӧ������Ӧ���� ___________��������С�����䣩���¶�����_________�������������ڣ���ؽ���ѧ��ת��Ϊ���ܡ� 
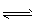 CO2��g��+H2��g���� CO��ת������ʱ��仯��ϵ��ͼ���ش��������⣺
CO2��g��+H2��g���� CO��ת������ʱ��仯��ϵ��ͼ���ش��������⣺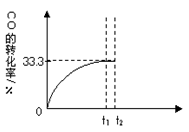
 ��У����ϵ�д�
��У����ϵ�д�

 ֱ�Ӽ״�ȼ�ϵ�أ�DNFC������Ϊ��21���͵綯������Ѻ�ѡ����Դ��
ֱ�Ӽ״�ȼ�ϵ�أ�DNFC������Ϊ��21���͵綯������Ѻ�ѡ����Դ��