
下列叙述正确的是( )
A.稀醋酸中加入少量醋酸钠能增大醋酸的电离程度
B.25℃时,等体积等浓度的硝酸与氨水混合后,溶液pH=7
C.25℃时,0.1mol·L-1的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱
D.0.1 mol AgCl和0.1mol AgI混合后加入1L水中,所得溶液中c(Cl-)=c(I-)
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
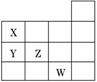 8如图表示元素周期表前四周期的一部分,关于元素X、Y、Z、W的叙述正确的是( )
8如图表示元素周期表前四周期的一部分,关于元素X、Y、Z、W的叙述正确的是( )
①X、Y的最高价氧化物对应的水化物的酸性为Y<X ②Y、Z的气态氢化物的稳定性Y<Z ③W的单质常温下呈液态,可与铁粉反应 ④W的原子序数比Z的大9
A.只有③ B.①②
C.①②③ D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
双水杨酯可用于缓解包括头痛、牙痛、神经痛、关节痛及软组织炎症等各类疼痛,其结构如图所示。下列关于双水杨酯的性质描述正确的是( )
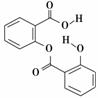
A.能与FeCl3溶液发生显色反应
B.能使酸性KMnO4溶液褪色
C.能发生加成、取代、消去反应
D.1 mol该物质最多可与2 mol NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关说法正确的是
A.SiO2是酸性氧化物,所以SiO2能与NaOH溶液反应
B.SO2可以使溴水褪色,所以SO2具有漂白性
C.若某碱性溶液的焰色反应呈黄色,则该溶液的溶质一定为NaOH
D.NH3的水溶液可以导电,所以NH3是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
氨基甲酸铵(H2NCOONH4)是一种白色固体,易水解、受热易分解,可用做肥料、灭火剂、洗涤剂等。某化学兴趣小组模拟制备氨基甲酸铵,反应的化学方程式如下:2NH3(g)+CO2(g) H2NCOONH4(s) △H<0
H2NCOONH4(s) △H<0
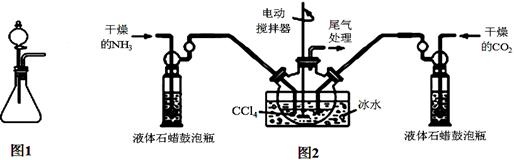
(注:四氯化碳与液体石蜡均为惰性介质)
(1)如用图1装置制取氨气,分液漏斗中的试剂名称是 。
(2)制备氨基甲酸铵的装置如图2所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。
①发生器用冰水冷却的目的是 。
液体石蜡鼓泡瓶的作用是 。
 ②从反应后的混合物中分离出产品的实验方法是 (填操作名称)。为了得到纯净的产品,应采取的方法是 (填选项序号)。
②从反应后的混合物中分离出产品的实验方法是 (填操作名称)。为了得到纯净的产品,应采取的方法是 (填选项序号)。
a. 常压加热烘干 b. 高压加热烘干 c. 减压40 ℃以下烘干
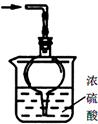
③尾气处理装置如右图所示。球形干燥管的作用: ;
浓硫酸的作用: 。
(3)取因部分变质而混有NH4HCO3的氨基甲酸铵样品15.64g,用足量石灰水充分处理后,使样品中所有碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为20 g。则样品中氨基甲酸铵的物质的量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃时,在10mL浓度均为0.1mol/LNaOH和NH3·H2O混合溶液中,滴加0.1mol/L的盐酸,下列有关溶液中粒子浓度关系正确的是( )
A.未加盐酸时:c(OH-)>c(Na+)= c(NH3·H2O)
B.加入10mL盐酸时:c(NH4+) +c(H+) = c(OH-)
C.加入盐酸至溶液pH=7时:c(Cl-) = c(Na+)
 D.加入20mL盐酸时:c(Cl-) =c(NH4+) +c(Na+)
D.加入20mL盐酸时:c(Cl-) =c(NH4+) +c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量。O3氧化烟气中SO2、NOx的主要反应的热化学方程式为:
NO(g)+O3(g)=NO2(g)+O2(g) △H=-200.9kJ·mol-1
NO(g)+1/2O2(g)=NO2(g) △H=-58.2kJ·mol-1
SO2(g)+O3(g)=SO3(g)+O2(g) △H=-241.6kJ·mol-1
(1)反应3NO(g)+O3(g)=3NO2(g)的△H=_______mol·L-1。
(2)室温下,固定进入反应器的NO、SO2的物质的量,改变加入O3的物质的量,反应一段时间后体系中n(NO)、n(NO2)和n(SO2)随反应前n(O3):n(NO)的变化见右图。
①当n(O3):n(NO)>1时,反应后NO2的物质的量减少,其原因是__________。
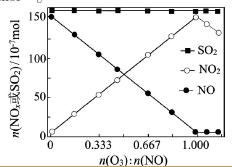 ②增加n(O3),O3氧化SO2的反应几乎不受影响,其可能原因是 _________。
②增加n(O3),O3氧化SO2的反应几乎不受影响,其可能原因是 _________。
(3)当用CaSO3水悬浮液吸收经O3预处理的烟气时,清液(pH约为 8)中SO32-将NO2转化为NO2-,其离子方程式为:___________。
(4)CaSO3水悬浮液中加入Na2SO4溶液,达到平衡后溶液中c(SO32-)=________[用c(SO42-)、Ksp(CaSO3)和Ksp(CaSO4)表示];CaSO3水悬浮液中加入Na2SO4溶液能提高NO2的吸收速率,其主要原因是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
为探讨化学平衡移动原理与氧化还原反应规律的联系,某同学通过改变浓度研究“2Fe3++2I- 2Fe2++I2”反应中Fe3+和Fe2+的相互转化。实验如下:
2Fe2++I2”反应中Fe3+和Fe2+的相互转化。实验如下:
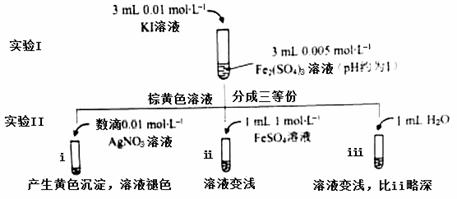
(1)待实验I溶液颜色不再改变时,再进行实验II,目的是使实验I的反应达到 。
(2)iii是ii的对比试验,目的是排除有ii中 造成的影响。
(3)i和ii的颜色变化表明平衡逆向移动,Fe2+向Fe3+转化。用化学平衡移动原理解释原因: 。
(4)根据氧化还原反应的规律,该同学推测i中Fe2+向Fe3+转化的原因:外加Ag+使c(I-)降低,导致I-的还原性弱于Fe2+,用右图装置(a、b均为石墨电极)进行实验验证。
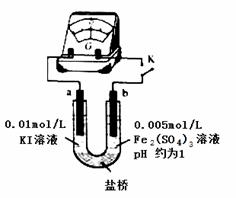
①K闭合时,指针向右偏转,b作 极。
②当指针归零(反应达到平衡)后,向U型管左管滴加0.01 mol/L AgNO3溶液,产生的现象证实了其推测,该现象是 。
(5)按照(4)的原理,该同学用上图装置进行实验,证实了ii中Fe2+向Fe3+转化的原因,
①转化原因是 。
②与(4)实验对比,不同的操作是 。
(6)实验I中,还原性:I->Fe2+;而实验II中,还原性:Fe2+>I-,将(3)和(4)、(5)作对比,得出的结论是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890 kJ·mol-1
现有H2与CH4的混合气体112 L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应放热3 695 kJ,则原混合气体中H2与CH4的物质的量之比是( )
A.1∶1 B.1∶3 C.1∶4 D.2∶3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com