
 如图中,A是单质,B为淡黄色固体.写出下列转化的化学方程式:
如图中,A是单质,B为淡黄色固体.写出下列转化的化学方程式:分析 A是单质,B为淡黄色固体,且B能与CO2、水反应,则B是Na2O2,A为Na,过氧化钠与水、Na与水反应都得到C,则C为NaOH,C能与二氧化碳反应得到D,过氧化钠与二氧化碳反应也得到D,则D为Na2CO3,以此解答该题.
解答 解:A是单质,B为淡黄色固体,且B能与CO2、水反应,则B是Na2O2,A为Na,过氧化钠与水、Na与水反应都得到C,则C为NaOH,C能与二氧化碳反应得到D,过氧化钠与二氧化碳反应也得到D,则D为Na2CO3.
①A→B是钠燃烧生成过氧化钠,反应方程式为:2Na+O2$\frac{\underline{\;点燃\;}}{\;}$Na2O2;
②B→D是过氧化钠与二氧化碳反应生成碳酸钠与氧气,反应方程式为:2Na2O2+2CO2=2Na2CO3+O2;
③B→C是过氧化钠钠与水反应生成氢氧化钠与氧气,反应方程式为:2Na2O2+2H2O=4NaOH+O2↑;
④A→C是钠与水反应生成氢氧化钠与氢气,反应方程式为:2Na+2H2O=2NaOH+H2↑;
⑤C→D是二氧化碳与氢氧化钠反应生成碳酸钠与水,反应方程式为:2NaOH+CO2=Na2CO3+H2O,
故答案为:2Na+O2$\frac{\underline{\;点燃\;}}{\;}$Na2O2;2Na2O2+2CO2=2Na2CO3+O2;2Na2O2+2H2O=4NaOH+O2↑;2Na+2H2O=2NaOH+H2↑;2NaOH+CO2=Na2CO3+H2O.
点评 本题考查无机物的推断,侧重于钠及其化合物之间的转化,明确物质的性质是解本题关键,B的颜色及能与水、二氧化碳反应为推断突破口,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
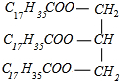 +3NaOH→3C17H35COONa+
+3NaOH→3C17H35COONa+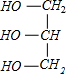
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
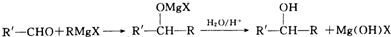
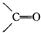 )化合物:
)化合物: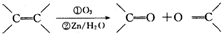
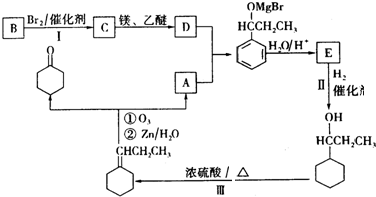
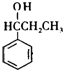 .
.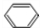 +Br2$\stackrel{催化剂}{→}$
+Br2$\stackrel{催化剂}{→}$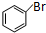 +HBr.
+HBr. +3H2$\stackrel{催化剂}{→}$
+3H2$\stackrel{催化剂}{→}$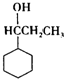 .
.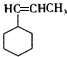 .F在一定条件下发生加聚反应的化学方程式是n
.F在一定条件下发生加聚反应的化学方程式是n $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$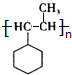 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | vA=0.05mol/(L•s) | B. | vB=0.03mol/(L•s) | C. | vC=3.6mol/(L•min) | D. | vD=0.1mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | M | R | Q | |
| 原子半径(×10 -10m) | 1.86 | 0.99 | 1.43 | 1.60 | 0.75 | 0.74 | |
| 主要化合价 | 最高正价 | +1 | +7 | +3 | +2 | +5 | -- |
| 最低负价 | -- | -1 | -- | --- | -3 | -2 | |
| A. | X、Z、M的最简单离子半径大小为X>M>Z | |
| B. | X、Z、R的最高价氧化物的水化物之间不可两两相互反应 | |
| C. | R的氢化物比Q的氢化物沸点高、更稳定 | |
| D. | Y的氢化物的水溶液可用于雕刻玻璃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 测定硫酸铜晶体中结晶水的含量,失水后的硫酸铜晶体置于空气中冷却后再称量质量 | |
| B. | 测定中和热实验中,所使用的氢氧化钠稀溶液的物质的量浓度稍大于盐酸 | |
| C. | 配制一定的物质的量浓度溶液的实验中,容量瓶内壁附有蒸馏水 | |
| D. | 用标准盐酸滴定未知浓度的氢氧化钠溶液,开始俯视读数,终点仰视读数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com