
【题目】下表为元素周期表的一部分。
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
一 | ① | ||||||
二 | ② | ③ | ④ | ⑤ | ⑥ | ||
三 | ⑦ | ⑧ | ⑨ | ⑩ | |||
四 | |||||||
(1)表中元素__
(2)表中元素⑦的原子结构示意图为__,在周期表中的位置为____
(3)表中元素⑥⑩的氢化物的稳定性顺序为__(填写化学式,下同)。
(4)表中元素⑩的最高价氧化物对应水化物的酸性:__。
(5)表中元素②和⑦的最高价氧化物对应水化物的碱性:__。
【答案】F K Br  第三周期IA族 HF>HCl HClO4>HBrO4 NaOH>LiOH
第三周期IA族 HF>HCl HClO4>HBrO4 NaOH>LiOH
【解析】
根据题给图表,可判断:①为H,②为Li,③为C,④为N,⑤为O,⑥为F,⑦为Na,⑧为Mg,⑨为S,⑩为Cl,为K,为Al,为Br。可在此基础上解各小题。
(1)元素周期表中右上角(零族除外)元素非金属性最强,左下角金属性最强。所以,表中F的非金属性最强,K的金属性最强;Br的单质Br2室温下呈液态。
答案为:F;K;Br;
(2)表中元素⑦为Na,原子结构示意图为 ,在周期表中的位置为第三周期IA族。
,在周期表中的位置为第三周期IA族。
答案为: ;第三周期IA族;
;第三周期IA族;
(3)表中元素⑥、⑩分别为F、Cl,同主族元素,随核电荷数的增大,非金属性逐渐减弱,氢化物稳定性逐渐下降。所以氢化物的稳定性顺序为HF>HCl。
答案为:HF>HCl;
(4)表中元素⑩分别为Cl、Br,同主族元素,随核电荷数的增大,非金属性逐渐减弱,最高价氧化物对应水化物的酸性逐渐减弱。所以最高价氧化物对应水化物的酸性:HClO4>HBrO4。
答案为:HClO4>HBrO4;
(5)表中元素②和⑦分别为Li、Na,同主族元素,随核电荷数的增大,金属性逐渐增强,最高价氧化物对应水化物的碱性逐渐增强。所以最高价氧化物对应水化物的碱性:NaOH>LiOH。
答案为:NaOH>LiOH。


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
【题目】硝酸生产中,500℃时,NH3和O2可能发生如下反应:
① 4NH3 (g) + 5O2 (g) ![]() 4NO (g) + 6H2O (g);△H = -907.2kJ·mol-1 K=1.1×1026
4NO (g) + 6H2O (g);△H = -907.2kJ·mol-1 K=1.1×1026
② 4NH3 (g) + 4O2 (g) ![]() 2N2O (g) + 6H2O (g);△H= -1104.9kJ·mol-1 K=4.4×1028
2N2O (g) + 6H2O (g);△H= -1104.9kJ·mol-1 K=4.4×1028
③ 4NH3 (g) + 3O2 (g) ![]() 2N2 (g) + 6H2O (g);△H= -1269.2kJ·mol-1 K=7.1×1034
2N2 (g) + 6H2O (g);△H= -1269.2kJ·mol-1 K=7.1×1034
下列说法正确的是
A.增大压强,则反应的②K不变,反应①和③的K减小
B.500℃时,2NH3 (g) + 2O2 (g) ![]() N2O (g) + 3H2O (g) K=2.2×1028
N2O (g) + 3H2O (g) K=2.2×1028
C.500℃时,N2 (g) + O2 (g)= 2NO (g) △H = +181 kJ·mol-1
D.500℃时,2 mol NH3 与2.5 mol O2混合发生反应①,可放出热量453.6 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家提出如下光分解法制备氢气:
①2Ce4+(aq)+H2O(l)===2Ce3+(aq)+![]() O2(g)+2H+(aq) ΔH1
O2(g)+2H+(aq) ΔH1
②Ce3+(aq)+H2O(l)===Ce4+(aq)+![]() H2(g)+OH-(aq) ΔH2
H2(g)+OH-(aq) ΔH2
③H2O(l)===H+(aq)+OH-(aq) ΔH3
④2H2O(l)===2H2(g)+O2(g) ΔH4
下列说法正确的是( )
A. Ce4+能够增大水分解反应的活化能,提高反应速率
B. Ce3+是反应②和反应③的催化剂
C. 上述反应中,ΔH4=2ΔH1+4ΔH2-4ΔH3
D. 通常条件下,反应④中生成H2、O2的速率之比为1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酯A,其分子式C6H12O2,已知
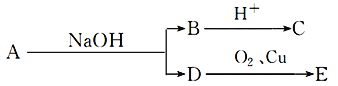
又知B、C、D、E均为有机物,D不与Na2CO3溶液反应,E不能发生银镜反应,则A结构可能有( )
A. 5种 B. 4种 C. 3种 D. 2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对SCN-的性质进行探究,设计了以下实验

已知:(CN)2、(SCN)2、(OCN)2等称之为拟卤素,它们的化学性质均与卤素单质相似。下列说法正确的是( )
A.溶液颜色变红时发生反应的离子方程式是:Fe3++3SCN-=Fe(SCN)3↓
B.红色溶液褪色表现了SO2的漂白性
C.氧化性:KMnO4>Fe3+>(SCN)2
D.无色溶液Ⅱ中滴入适量的KMnO4(H+)溶液,溶液又变成红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气既是一种优质的能源,又是一种重要化工原料,高纯氢的制备是目前的研究热点。
(1)甲烷水蒸气催化重整是制备高纯氢的方法之一,甲烷和水蒸气反应的热化学方程式是:
CH2(g)+2H2O(g)![]() CO2(g)+4H2(g) △H=+165.0kJ·mol-1
CO2(g)+4H2(g) △H=+165.0kJ·mol-1
已知反应器中存在如下反应过程:
I.CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H1=+206.4kJ·mol-1
CO(g)+3H2(g) △H1=+206.4kJ·mol-1
II.CO(g)+H2O(g)![]() CO2(g)+H2(g) △H2
CO2(g)+H2(g) △H2
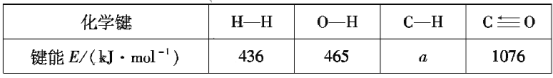
根据上述信息计算:a=___、△H2=___。
(2)某温度下,4molH2O和lmolCH4在体积为2L的刚性容器内同时发生I、II反应,达平衡时,体系中n(CO)=bmol、n(CO2)=dmol,则该温度下反应I的平衡常数K值为___(用字母表示)。
(3)欲增大CH4转化为H2的平衡转化率,可采取的措施有___(填标号)。
A.适当增大反应物投料比武n(H2O):n(CH4)
B.提高压强
C.分离出CO2
(4)H2用于工业合成氨:N2+3H2![]() 2NH3。将n(N2):n(H2)=1:3的混合气体,匀速通过装有催化剂的反应器反应,反应器温度变化与从反应器排出气体中NH3的体积分数φ(NH3)关系如图,反应器温度升高NH3的体积分数φ(NH3)先增大后减小的原因是___。
2NH3。将n(N2):n(H2)=1:3的混合气体,匀速通过装有催化剂的反应器反应,反应器温度变化与从反应器排出气体中NH3的体积分数φ(NH3)关系如图,反应器温度升高NH3的体积分数φ(NH3)先增大后减小的原因是___。
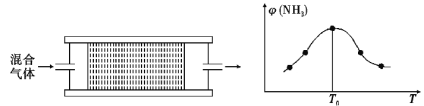
某温度下,n(N2):n(H2)=1:3的混合气体在刚性容器内发生反应,起始气体总压为2×l07Pa,平衡时总压为开始的90%,则H2的转化率为___,气体分压(p分)=气体总压(p总)×体积分数,用某物质的平衡分压代替物质的量浓度也可以表示化学平衡常数(记作Kp),此温度下,该反应的化学平衡常数Kp=___(分压列计算式、不化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的常见短周期元素,X的某种氢化物能使湿润的红色石蕊试纸变蓝.Y的一种核素质量数为18,中子数为10.在同周期元素中Z的简单离子半径最小,W的单质是良好的半导体材料。下列说法中正确的是
A. 简单气态氢化物稳定性:W >X
B. Y元素的相对原子质量为18
C. X2H4的分子中极性键和非极性键数目比为4:l
D. 电解Z的熔融氯化物可以冶炼单质Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知充分燃烧a g乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是()
A.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);ΔH=+2b kJ/mol
B.C2H2(g)+![]() O2(g)=2CO2(g)+H2O(l);ΔH=-2b kJ/mol
O2(g)=2CO2(g)+H2O(l);ΔH=-2b kJ/mol
C.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);ΔH=-2b kJ/mol
D.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);ΔH=-b kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各图的叙述,正确的是

A. 图甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为483.6 kJ·mol-1
B. 图乙表示反应2SO2(g)+O2(g)![]() 2SO3(g)在其他条件不变时,O2的转化率随
2SO3(g)在其他条件不变时,O2的转化率随![]() 的变化关系
的变化关系
C. 图丙表示用0.100 0 mol·L-1的盐酸滴定20.00 mL 0.100 0 mol·L-1Na2CO3溶液的曲线,从A点到B点反应的离子方程式为:CO32-+2H+![]() CO2↑+H2O
CO2↑+H2O
D. 图丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液的pH随加水量的变化,则同浓度溶液的pH:NaA<NaB
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com