
°ĺŐ‚ńŅ°Ņ“‘»Ū√ŐŅů∑Řń©£®÷ų“™≥…∑÷MnO2£¨ĽĻļ¨”–Al2O3°ĘFe2O3Ķ»‘”÷ £©ő™‘≠ŃŌ÷∆MnSO4°§H2OĶńĻ§“’Ńų≥Ő»ÁŌ¬£ļ
“—÷™£ļpH£ĺ3.3ļů»‹“ļ≤Ľīś‘ŕFe3+£¨pH£ĺ5.0ļů»‹“ļ≤Ľīś‘ŕAl3+£¨pH£ĺ8ļůMn2+Ņ™ ľ≥ŃĶŪ°£
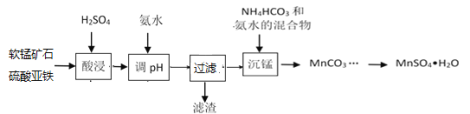
£®1£©Ī£≥÷∆šňŻŐűľĢ≤ĽĪš£¨‘ŕ≤ĽÕ¨ő¬∂»Ō¬∂‘ļ¨»Ū√ŐŅů∑ŘĹÝ––ňŠĹĢ£¨√ŐĹĢ≥Ų¬ ňś ĪľšĪšĽĮ»ÁÕľ°£ňŠĹĢĶń◊Óľ—ő¬∂»”Ž Īľš∑÷Īūő™________°ś°Ę______min°£
£®2£©°įňŠĹĢ°Ī Ī£¨ĽŠĹęFe2+—űĽĮ÷ŃFe3+£¨ňý∑Ę…ķĶń∑ī”¶ņŽ◊”∑Ĺ≥Ő Ĺő™__________°£
£®3£©ňŠĹĢ Ī“™ľ”»ŽŃÚňŠ£¨ŃÚňŠŇ®∂»≤Ľń‹ĻżīůĽÚ’ŖĻż–°°£ĶĪŃÚňŠŇ®∂»Ļż–° Ī£¨ňŠĹĢĽŠ”–ļžļ÷…ę≤–‘Ł≥ŲŌ÷£¨‘≠“Ú «_____________________________°£
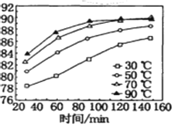
£®4£©MnSO4‘ŕňģ÷–Ķń»‹Ĺ‚∂»”Žő¬∂»ĻōŌĶ»ÁÕľ°£”…MnCO3ĽŮĶ√ĹŌīŅĺĽĶńMnSO4H2OĺßŐŚĶń∑Ĺ∑® «£ļĹęMnCO3»‹”ŕ_________£¨Ņō÷∆ő¬∂»ő™_________“‘…ŌĹŠĺߣ¨Ķ√ĶĹMnSO4H2OĺßŐŚ£¨ŌīĶ”°Ęļśł…°£
°ĺīūįł°Ņ70°ś 120min …ķ≥…ĶńFe3+ňģĹ‚Ķ√ĶĹFe(OH)3≥ŃĶŪ 2Fe2+£ęMnO2£ę4H+£Ĺ2Fe3+£ęMn2+£ę2H2O ŃŅĶńŌ°ŃÚňŠ 90°ś
°ĺĹ‚őŲ°Ņ
(1)łýĺ›ÕľŌŮŅ…÷™£¨ Īľš‘ŕ120min Ī£¨ő¬∂»‘ŕ70°śļÕ90°ś ĪĹĢ≥Ų¬ īÔĶĹ90%£Ľ
(2)°įňŠĹĢ°Ī Ī£¨∂Ģ—űĽĮ√Ő‘ŕňŠ–‘ŐűľĢŌ¬ĹęFe2+—űĽĮ÷ŃFe3+£Ľ
(3)ĶĪŃÚňŠŇ®∂»Ļż–° Ī£¨»‹“ļ÷–ĶńŐķņŽ◊”…ķ≥…«‚—űĽĮŐķ≥ŃĶŪ£Ľ
(4)łýĺ›ÕľŌŮĹÝ––Ň–∂Ō°£
(1)łýĺ›ÕľŌŮŅ…÷™£¨ Īľš‘ŕ120min Ī£¨ő¬∂»‘ŕ70°śļÕ90°ś ĪĹĢ≥Ų¬ īÔĶĹ90%£¨‘Ú◊Óľ—ő¬∂»ő™70°ś£¨ Īľšő™120min£Ľ
(2)°įňŠĹĢ°Ī Ī£¨∂Ģ—űĽĮ√Ő‘ŕňŠ–‘ŐűľĢŌ¬ĹęFe2+—űĽĮ÷ŃFe3+£¨‘ÚņŽ◊”∑Ĺ≥Ő Ĺő™2Fe2+£ęMnO2£ę4H+£Ĺ2Fe3+£ęMn2+£ę2H2O£Ľ
(3)ĶĪŃÚňŠŇ®∂»Ļż–° Ī£¨»‹“ļ÷–ĶńŐķņŽ◊”…ķ≥…«‚—űĽĮŐķ≥ŃĶŪ£Ľ
(4)”√ŐľňŠ√Ő÷∆»°MnSO4H2O£¨ĹęMnCO3»‹”ŕ ŃŅĶńŌ°ŃÚňŠ£¨łýĺ›ÕľŌŮŅō÷∆ő¬∂»‘ŕ90°ś“‘…Ō°£



| ńÍľ∂ | łŖ÷–Ņő≥Ő | ńÍľ∂ | ≥ű÷–Ņő≥Ő |
| łŖ“Ľ | łŖ“Ľ√‚∑—Ņő≥ŐÕ∆ľŲ£° | ≥ű“Ľ | ≥ű“Ľ√‚∑—Ņő≥ŐÕ∆ľŲ£° |
| łŖ∂Ģ | łŖ∂Ģ√‚∑—Ņő≥ŐÕ∆ľŲ£° | ≥ű∂Ģ | ≥ű∂Ģ√‚∑—Ņő≥ŐÕ∆ľŲ£° |
| łŖ»ż | łŖ»ż√‚∑—Ņő≥ŐÕ∆ľŲ£° | ≥ű»ż | ≥ű»ż√‚∑—Ņő≥ŐÕ∆ľŲ£° |
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°Ņ1Lń≥ĽžļŌ»‹“ļ£¨÷ĽŅ…ń‹ļ¨”–Ō¬ĪŪ÷–Ķń»Űł…÷÷ņŽ◊”£ļ
Ņ…ń‹īůŃŅļ¨”–Ķń—ŰņŽ◊” |
|
Ņ…ń‹īůŃŅļ¨”–Ķń“űņŽ◊” |
|
ĶĪŌÚł√»‹“ļ÷–ľ”»Ž“Ľ∂®őÔ÷ ĶńŃŅŇ®∂»ĶńNaOH»‹“ļ Ī£¨∑ĘŌ÷…ķ≥…≥ŃĶŪĶńőÔ÷ ĶńŃŅňśNaOH»‹“ļĶńŐŚĽżĪšĽĮĶńÕľŌů»ÁÕľňý ĺ£¨Ō¬Ń–ňĶ∑®’ż»∑Ķń «![]()
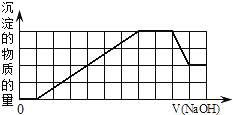
A.‘≠»‹“ļ÷–ľ”»Ž—őňŠ”–≥ŃĶŪ…ķ≥…
B.‘≠»‹“ļ÷–“Ľ∂®ļ¨”–![]() ļÕ
ļÕ![]()
C.∑ī”¶◊ÓļůĶ√ĶĹĶń≥ŃĶŪ÷Ľ”–![]()
D.∑ī”¶◊Óļů–ő≥…Ķń»‹“ļ÷–»‹÷ ÷Ľ”–![]()
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°Ņ∂‘”ŕ∑Ň»»∑ī”¶H2 + Cl2![]() 2HCl£¨Ō¬Ń–ňĶ∑®’ż»∑Ķń «£ļ
2HCl£¨Ō¬Ń–ňĶ∑®’ż»∑Ķń «£ļ
A.≤ķőÔňýĺŖ”–Ķń◊‹ń‹ŃŅłŖ”ŕ∑ī”¶őÔňýĺŖ”–Ķń◊‹ń‹ŃŅ
B.∑ī”¶őÔňýĺŖ”–Ķń◊‹ń‹ŃŅłŖ”ŕ≤ķőÔňýĺŖ”–Ķń◊‹ń‹ŃŅ
C.∂ŌŅ™1mol H°™HľŁļÕ1mol Cl°™ClľŁňýőŁ ’Ķń◊‹ń‹ŃŅ–°”ŕ–ő≥…1mol H°™ClľŁňý∑Ň≥ŲĶńń‹ŃŅ
D.ł√∑ī”¶÷–£¨ĽĮ—ßń‹÷Ľ”–◊™Īšő™»»ń‹
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°ŅĽĮļŌőÔa°Ęb «ļŌ≥…“©őÔĶń÷–ľšŐŚ£®ĹŠĻĻľÚ Ĺľį◊™ĽĮ»ÁÕľňý ĺ£©£¨Ō¬Ń––ū Ų’ż»∑Ķń «£® £©
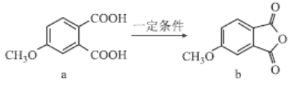
A.ĽĮļŌőÔa°Ębĺý“◊»‹”ŕňģ
B.a°ķbĶń◊™ĽĮ Ű”ŕű•ĽĮ∑ī”¶
C.a°Ęb÷–ĺý÷Ń…Ŕ”–8łŲŐľ‘≠◊”Ļ≤∆Ĺ√ś
D.aĶńļ¨ĪĹĽ∑ĶńÕ¨∑÷“žĻĻŐŚ÷–”Žaļ¨”–ŌŗaÕ¨»°īķĽýĶńĽĻ”–4÷÷£®≤ĽŅľ¬«ŃĘŐŚ“žĻĻ£©
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°Ņ£®1£©“—÷™£ļĘŔ C(s) + O2(g)£ĹCO2(g) H£Ĺ£≠393.5 kJmol£≠1
Ęŕ2CO(g) + O2(g)£Ĺ2CO2(g) H£Ĺ£≠566 kJmol£≠1
ĘŘTiO2(s) + 2Cl2(g)£ĹTiCl4(s) + O2(g) H£Ĺ+141 kJmol£≠1
‘ÚTiO2(s) + 2Cl2(g) + 2C(s)£ĹTiCl4(s) + 2CO(g)ĶńH£Ĺ_________________°£
£®2£©¬»ĽĮ“Ý‘ŕňģ÷–īś‘ŕ≥ŃĶŪ»‹Ĺ‚∆Ĺļ‚AgCl(s)![]() Ag+(aq) + Cl£≠(aq)°£25°ś Ī£¨¬»ĽĮ“ÝĶńKsp=1.8°Ń10-10£¨Ō÷Ĺę◊„ŃŅĶń¬»ĽĮ“Ýľ”»ŽĶĹ0.1 molL£≠1¬»ĽĮ¬Ń»‹“ļ÷–£¨“ÝņŽ◊”Ň®∂»◊ÓīůŅ…īÔĶĹ_____________molL£≠1°£
Ag+(aq) + Cl£≠(aq)°£25°ś Ī£¨¬»ĽĮ“ÝĶńKsp=1.8°Ń10-10£¨Ō÷Ĺę◊„ŃŅĶń¬»ĽĮ“Ýľ”»ŽĶĹ0.1 molL£≠1¬»ĽĮ¬Ń»‹“ļ÷–£¨“ÝņŽ◊”Ň®∂»◊ÓīůŅ…īÔĶĹ_____________molL£≠1°£
£®3£©20 °ś Ī£¨0.1 molL£≠1 NH4Al(SO4)2»‹“ļĶńpH£Ĺ3£¨‘Ú£ļ2c(SO42£≠)£≠c(NH4+)£≠3c(Al3+)°÷______________molL£≠1£®ŐÓ ż÷Ķ£©°£
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°ŅŌ¬ĪŪ «25°ś Ī»űňŠĶńĶÁņŽ∆Ĺļ‚≥£ ż£¨Ō¬Ń–ňĶ∑®’ż»∑Ķń «
CH3COOH | HClO | H2CO3 |
Ka=1.8°Ń10°™5 | Ka=3.0°Ń10°™8 | Ka1=4.1°Ń10°™7 Ka2=5.6°Ń10°™11 |
A.łýĺ›ĪŪ÷– żĺ›Ņ…÷™£¨ŌŗÕ¨Ň®∂»CH3COONaļÕNaClOĶńĽžļŌ»‹“ļ÷–£¨łų÷÷ņŽ◊”Ň®∂»Ķńīů–°ĻōŌĶ «£ļc(Na+)£ĺc(ClO©Ā)£ĺc(CH3COO©Ā)£ĺc(OH©Ā)£ĺc(H+)
B.łýĺ›ĪŪ÷– żĺ›Ņ…÷™£¨īő¬»ňŠń∆»‹“ļ÷–Õ®»Ž…ŔŃŅCO2ĶńņŽ◊”∑Ĺ≥Ő Ĺő™£ļ2ClO©Ā+CO2+H2O=CO32©Ā+2HClO
C.ŌÚ0.1mol°§L-1CH3COOH»‹“ļ÷–ľ”»Ž…ŔŃŅňģ£¨»‹“ļ÷– ľű–°
ľű–°
D. “ő¬Ō¬£¨ĹęŐľňŠń∆»‹“ļľ”»»÷Ń70°ś£¨»‹“ļĶń÷–ĶńOH°™ żńŅ‘Ų∂ŗ
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°ŅŌ¬Ń–ňĶ∑®≤Ľ’ż»∑Ķń «
A.∑ľŌ„ŐĢ «∑÷◊”◊ť≥…∑ŻļŌCnH2n-6(n°›6)Ķń“ĽņŗőÔ÷
B.ĪĹļÕŇ®ŌűňŠ‘ŕ55°ę60°ś£¨Ň®ŃÚňŠīś‘ŕ Ī∑Ę…ķŌűĽĮ∑ī”¶
C.ľ◊ĪĹŅ…“‘ļÕŇ®ŌűňŠ”ŽŇ®ŃÚňŠĶńĽžļŌőÔ∑Ę…ķŌűĽĮ∑ī”¶
D.Ķ»÷ ŃŅĶńŐĢ(CxHy)ļń—űŃŅ»°ĺŲ”ŕ![]() Ķń÷Ķ£¨‘Ĺīů‘Úļń—ű∂ŗ
Ķń÷Ķ£¨‘Ĺīů‘Úļń—ű∂ŗ
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°ŅĪĹľ◊»©£®őĘ»‹”ŕňģ°Ę“◊»‹”ŕ”–Ľķ»‹ľŃ£¨√‹∂»‘ľĶ»”ŕňģĶń√‹∂»£©‘ŕľÓ–‘ŐűľĢŌ¬∑Ę…ķ∆ÁĽĮ∑ī”¶Ņ…“‘÷∆ĪłĪĹľ◊ňŠļÕĪĹľ◊īľ£®‘ŕňģ÷–»‹Ĺ‚∂»≤Ľīů£¨“◊»‹”ŕ”–Ľķ»‹ľŃ£¨√‹∂»‘ľĶ»”ŕňģĶń√‹∂»£©°£∑ī”¶‘≠ņŪ»ÁŌ¬£ļ
2C6H5CHO+NaOH°ķC6H5CH2OH+C6H5COONa
C6H5COONa+HCl°ķC6H5COOH+NaCl
ŌŗĻōőÔ÷ őÔņŪ–‘÷ »ÁĪŪ£ļ
ĪĹľ◊»© | ĪĹľ◊īľ | ĪĹľ◊ňŠ. | ĪĹ | |
∑–Ķ„/°ś | 178 | 205 | 249 | 80 |
»ŘĶ„/°ś | 26 | -15 | 122 | 5.5 |
ĪĹľ◊ňŠ‘ŕňģ÷–Ķń»‹Ĺ‚ | ||
17°ś | 25°ś | 100°ś |
0.21g | 0.34g | 5.9g |
Ķ—ťŃų≥Ő»ÁŌ¬£ļ
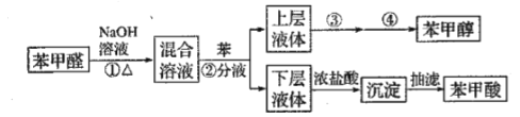
£®1£©≤Ŕ◊ųĘŔ–ŤŃ¨–Ýľ”»»1–° Ī£®»ÁÕľ1£©£¨∆š÷–ľ”»»ĻŐ∂®◊į÷√őīĽ≠≥Ų°£
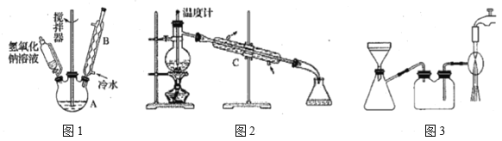
“«∆ųAĶń√Ż≥∆ő™___£¨»ŰĹę“«∆ųBłńő™Õľ2÷–Ķń“«∆ųC£¨–ßĻŻ≤Ľ»ÁB£¨«ŽňĶ√ų‘≠“Ú___°£
£®2£©≤Ŕ◊ųĘŕ”–Ļō∑÷“ļ¬©∂∑Ķń Ļ”√≤Ľ’ż»∑Ķń «___£®ŐÓ◊÷ńł£©°£
A.∑÷“ļ¬©∂∑‘ŕ Ļ”√÷ģ«įĪō–Žľž≤ť «∑٬©ňģ
B.∑÷“ļ¬©∂∑ńŕĶń“ļŐŚ≤Ľń‹Ļż∂ŗ£¨∑Ů‘Ú≤ĽņŻ”ŕ’ŮĶī
C.≥š∑÷’ŮĶīļůĹę∑÷“ļ¬©∂∑÷√”ŕŐķľ‹Ő®…Ōĺ≤÷√£¨∑÷≤„ļůŃĘľīīÚŅ™–ż»ŻĹÝ––∑÷“ļ
D.∑÷“ļ ĪīżŌ¬≤„“ļŐŚ∑ŇÕÍļůŃĘľīĻōĪ’–ż»Ż£¨ĽĽ“ĽłŲ…’Ī≠‘ŔīÚŅ™–ż»Ż Ļ…Ō≤„“ļŐŚŃųŌ¬
£®3£©≤Ŕ◊ųĘŘ «”√∑–ňģ‘°ľ”»»’ŰŃů£¨‘ŔĹÝ––≤Ŕ◊ųĘ‹£®»ÁÕľ2£©£¨ ’ľĮ___°śĶńŃů∑÷°£Õľ2÷–”–“Ľī¶√ųŌ‘īŪőů£¨’ż»∑Ķń”¶łńő™___°£
£®4£©≥ť¬ň Ī£®»ÁÕľ3£©…’Ī≠÷–ĪĹľ◊ňŠĺßŐŚ◊™»Ž≤ľ Ō¬©∂∑ Ī£¨Ī≠Īŕ…ŌĽĻ’≥”–…ŔŃŅĺßŐŚ£Ľ”√___≥ŚŌīĪ≠Īŕ…Ō≤–ŃŰĶńĺßŐŚ°£≥ť¬ňÕÍ≥…ļů”√…ŔŃŅĪýňģ∂‘ĺßŐŚĹÝ––ŌīĶ”£¨ŌīĶ”«į”¶Ō»___°£
£®5£©”√ĶÁ◊”Őž∆Ĺ◊ľ»∑≥∆»°0.2440gĪĹľ◊ňŠ”ŕ◊∂–ő∆Ņ÷–ľ”100mL’ŰŃůňģ»‹Ĺ‚£®Īō“™ ĪŅ…“‘ľ”»»£©£¨‘Ŕ”√0.1000mol°§L-1ĶńĪÍ◊ľ«‚—űĽĮń∆»‹“ļĶő∂®£¨Ļ≤ŌŻļńĪÍ◊ľ«‚—űĽĮń∆»‹“ļ19.20mL£¨ĪĹľ◊ňŠĶńīŅ∂»ő™___%°£
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°Ņń‹ ĻňģĶńĶÁņŽ∆Ĺļ‚”““∆£¨«“∆šňģ»‹“ļŌ‘ľÓ–‘ĶńņŽ◊” «
A. H+ B. OH- C. Al3+ D. HCO3-
≤ťŅīīūįłļÕĹ‚őŲ>>
įŔ∂»÷¬–Ň - Ń∑Ōį≤ŠŃ–ĪŪ - ‘Ő‚Ń–ĪŪ
ļĢĪĪ °Ľ•Ń™ÕÝő•∑®ļÕ≤ĽŃľ–ŇŌĘĺŔĪ®∆ĹŐ® | ÕÝ…Ō”–ļ¶–ŇŌĘĺŔĪ®◊®«Ý | ĶÁ–Ň’©∆≠ĺŔĪ®◊®«Ý | …śņķ ∑–ťőř÷ų“Ś”–ļ¶–ŇŌĘĺŔĪ®◊®«Ý | …ś∆ů«÷»®ĺŔĪ®◊®«Ý
ő•∑®ļÕ≤ĽŃľ–ŇŌĘĺŔĪ®ĶÁĽį£ļ027-86699610 ĺŔĪ®” Ōš£ļ58377363@163.com