
分析:在此反应中有些化合物中,元素的氧化数比较难于确定,用氧化数法配平比较困难,而用离子―电子法则比较方便。
解:(1)任何一个氧化还原反应都是由两个半反应组成的。因此可以将这个方程式分成两个未配平的半反应式,一个代表氧化,一个代表还原,对于此反应可以写成:
MnO![]() → Mn2+ (还原)
→ Mn2+ (还原)
C3H7OH → C2H5COOH(氧化)
(2)由于反应在酸性介质中进行,加H+和H2O配平半反应式两端的氢原子数,并使两端电荷数相等:
MnO![]() + 8 H+ +5e- = Mn2+ + 4H2O ①
+ 8 H+ +5e- = Mn2+ + 4H2O ①
C3H7OH + H2O = C2H5COOH + 4 H+ +4e- ②
(3)根据得失电子数必须相等,将两边电子消去,加合成一个已配平的反应式。
(①式×4)+(②式×5)得
4MnO![]() + 5C3H7OH +12 H+ = 5C2H5COOH + 4 Mn2+ + 11H2O
+ 5C3H7OH +12 H+ = 5C2H5COOH + 4 Mn2+ + 11H2O
(4)检验方程式两边氧原子数相等,配平正确。


科目:高中化学 来源: 题型:
- 4 |
2- 4 |
2- 4 |
1 4 |
2- 4 |
2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| O | - 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
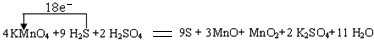
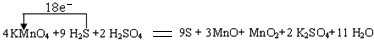
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com