
| 族 周期 |
I A | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ⑧ | ||||||
| 3 | ① | ③ | ⑤ | ⑦ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
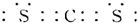 ;该物质的分子构型和CO2相同,所以二硫化碳为直线形分子,故答案为:
;该物质的分子构型和CO2相同,所以二硫化碳为直线形分子,故答案为: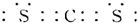 ;直线;
;直线;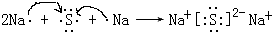 ,
,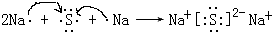 ;
;

 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案科目:高中化学 来源: 题型:
| A、1.0 | B、2.0 |
| C、3.0 | D、4.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
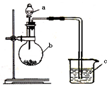 已知:元素最高价氧化物对应的水化物酸性越强,元素原子的得电子能力越强.某化学兴趣小组同学为了验证硫与碳的得电子能力的强弱,用如图所示装置设计实验.根据要求回答问题:
已知:元素最高价氧化物对应的水化物酸性越强,元素原子的得电子能力越强.某化学兴趣小组同学为了验证硫与碳的得电子能力的强弱,用如图所示装置设计实验.根据要求回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D、E为5种短周期元素,相对位置如图:
A、B、C、D、E为5种短周期元素,相对位置如图:查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | 实验温度/℃ | c(Na2S2O3)/mol?L-1 | c(H2SO4)/mol?L-1 |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.1 | 0.2 |
| ③ | 50 | 0.2 | 0.1 |
| ④ | 50 | 0.1 | 0.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 一 | ① | ② | ||||||
| 二 | ④ | ⑥ | ⑦ | |||||
| 三 | ⑧ | ⑨ | ⑩ | ③ | ⑤ | |||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
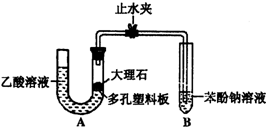 某校学生小组为探究乙酸、碳酸和苯酚的酸性强弱并证明乙酸为弱酸,进行下述实验.
某校学生小组为探究乙酸、碳酸和苯酚的酸性强弱并证明乙酸为弱酸,进行下述实验.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com