
| A. | 稀硫酸滴在铜片上:Cu+2H+═Cu2++H2 | |
| B. | 氧化铜与硫酸反应:O2-+2 H+═H2O | |
| C. | 硫酸钠和氯化钡两种溶液混合:Ba2++SO42-═BaSO4↓ | |
| D. | 盐酸与石灰石反应:CaCO3+2H+═Ca2++H2O+CO2↑ |
分析 A.Cu与稀硫酸不反应;
B.CuO在离子反应中保留化学式;
C.反应生成硫酸钡和氯化钠;
D.反应生成氯化钙、水、二氧化碳.
解答 解:A.稀硫酸滴在铜片上,不发生反应,故A错误;
B.氧化铜与硫酸反应的离子反应为CuO+2H+═Cu2++H2O,故B错误;
C.硫酸钠和氯化钡两种溶液混合的离子反应为Ba2++SO42-═BaSO4↓,故C正确;
D.盐酸与石灰石反应的离子反应为CaCO3+2H+═Ca2++H2O+CO2↑,故D正确;
故选CD.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | Y元素最高价氧化物对应的水化物化学式为H3YO4 | |
| B. | 原子半径由大到小的顺序为W>Z>Y>X | |
| C. | X、Z两种元素的氧化物中所含化学键类型相同 | |
| D. | 与同浓度的盐酸反应,Z比W更剧烈 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.
 (或
(或 、
、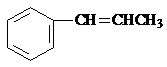 ) .
) .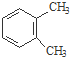 $→_{一定条件}^{Cl_{2}}$
$→_{一定条件}^{Cl_{2}}$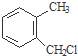 $→_{③}^{NaCN}$
$→_{③}^{NaCN}$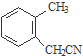 $→_{H_{2}O}^{H_{2}SO_{4}}$
$→_{H_{2}O}^{H_{2}SO_{4}}$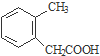
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 陶瓷不属于金属材料 | |
| B. | 钠钾合金的熔点介于钠和钾的熔点之间 | |
| C. | 纯铁比生铁的硬度大 | |
| D. | 铝在常温下不能与氧气反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
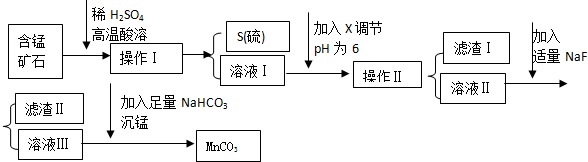
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Ca(OH)2 | 12 | ------ |
| Al(OH)3 | 3.8 | 4.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸的摩尔质量是98 g•mol-1 | |
| B. | 2 mol NO和1 mo1 NO2所含的氧元素质量相同 | |
| C. | 等质量的02和03所含氧原子数相等 | |
| D. | 等物质的量的CO和CO2所含氧原子数相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com