
【题目】下列有关元素的性质及其递变规律正确的是( )
A.IA族与ⅦA族元素间形成的化合物都是离子化合物
B.第三周期元素从左到右,最高正价从+1递增到+7
C.同主族元素的简单阴离子还原性越强,其单质的氧化性越强
D.同周期金属元素的化合价越高,其原子失电子能力越强
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A. NaHCO3溶液中加足量Ba(OH)2溶液:HCO3ˉ+Ba2++OH-= BaCO3↓+H2O
B. 单质铜与稀硝酸反应:Cu + 2H+ +2NO3- = Cu2+ + 2NO +H2O
C. 用醋酸溶液除水垢中的CaCO3:CaCO3+2H+ = Ca2++H2O+CO2↑
D. 实验室用MnO2和浓盐酸制取Cl2: MnO2+4HCl(浓)![]() Mn2+ + 2Cl- + Cl2↑ + 2H2O
Mn2+ + 2Cl- + Cl2↑ + 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列现象是因为发生取代反应的是( )
A. 乙烯使酸性KMnO4溶液褪色 B. 乙烯使溴水褪色
C. 点燃乙烯出现黑烟 D. 甲烷与氯气的混合气体,光照一段时间后褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.1mol/L CH3COOH溶液中存在如下电离平衡:CH3COOH![]() CH3COO- + H+,对于该平衡,下列叙述正确的是( )
CH3COO- + H+,对于该平衡,下列叙述正确的是( )
A. 加入少量CH3COONa固体,平衡正向移动
B. 加入少量NaOH固体,平衡正向移动
C. 加入少量0.1mol/L HCl溶液,溶液中c(H+)减小
D. 加入水,平衡逆向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂--磷酸氧铜电池正极的的活性物质是Cu4O(PO4)2,可通过下列反应制备:2Na3PO4+CuSO4+2NH3·H2O= Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O。
(1)写出基态Cu2+的电子排布式:_______________。
(2)PO43-的空间构型是___________________。
(3)P、S元素第一电离能大小关系为_____________________。
(4)氨基乙酸铜分子结构如图,碳原子的杂化方式为_____________,基态碳原子核外电子有__________个空间运动状态。
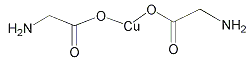
(5)铜晶体密堆积方式如图所示,铜原子的配位数为___________,铜的原子半径为127.8pm,NA表示阿伏加德罗常数的值,列出晶体铜的密度计算式_________g·cm-3。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种以2 molL-1的Na2SO4溶液为电解质溶液的钠离子电池的总反应如下:NaTi2(PO4)3+Zn+Na2SO4![]() Na3Ti2(PO4)3+ZnSO4下列有关说法正确的是
Na3Ti2(PO4)3+ZnSO4下列有关说法正确的是
A. 放电时,NaTi2(PO4)3发生氧化反应
B. 放电时,Na+向锌棒一极移动
C. 充电时,阳极反应式为[Ti2(PO4)3]--2e-=[Ti2(PO4)3]3-
D. 充电时,每转移0. 2 mol电子,阴极增重6.5 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.实验室常用以下几种方法制取氯气。
(1)二氧化锰与浓盐酸反应制氯气,写出其反应的离子方程式:________________________________________________________________________。
(2)高锰酸钾与浓盐酸反应制氯气,写出其反应的化学方程式:________________________________________________________________________。
(3)氯酸钾与浓盐酸反应制氯气,该反应中氧化产物与还原产物的物质的量之比为________。
Ⅱ.某研究性学习小组利用下列装置制备漂白粉,并进行漂白粉有效成分的质量分数的测定。
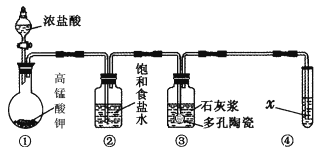
(1) 装置③中发生反应的化学方程式为____________________________,该反应是放热反应,反应温度较高时有副反应发生,改进该实验装置以减少副反应发生的方法是________________________________________________________________________。
(2)测定漂白粉有效成分的质量分数:称取1.000 g漂白粉于锥形瓶中,加水溶解,调节溶液的pH,以淀粉为指示剂,用0.100 0 mol·L-1KI溶液进行滴定,溶液出现稳定浅蓝色时为滴定终点。反应原理为
3ClO-+I-===3Cl-+IO
IO+5I-+3H2O===6OH-+3I2
实验测得数据如下表所示。
滴定次数 | 1 | 2 | 3 |
KI溶液体积/mL | 19.98 | 20.02 | 20.00 |
该漂白粉中有效成分的质量分数为________;若滴定过程中未充分振荡溶液,局部变浅蓝色时就停止滴定,则测定结果将________(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com