
下列除杂质的方法不可行的是
A.除去NaHCO3溶液中少量的Na2CO3:通入过量的CO2
B.除去FeCl2溶液中少量的FeCl3:加入稍过量铁粉,过滤
C.除去K2CO3固体中少量NaHCO3:置于坩埚中加热
D.用盐酸除去AgCl中少量的Ag2CO3
科目:高中化学 来源:2014-2015学年湖北省仙桃天门潜江高三上学期期末联考理综化学试卷(解析版) 题型:选择题
下列说法正确的是
A.水的离子积KW只与温度有关,但外加酸、碱、盐一定会影响水的电离程度
B.Ksp不仅与难溶电解质的性质和温度有关,还与溶液中相关离子的浓度有关
C.常温下,在0.10 mol·L-1的NH3·H2O溶液中加入少量NH4C1晶体,能使溶液的pH减小,c(NH4+)/c(NH3·H2O)的比值增大
D.室温下,CH3COOH的 ,NH3·H2O的
,NH3·H2O的 ,CH3COOH溶液中的c (H+)与NH3·H2O中的c(OH-)相等
,CH3COOH溶液中的c (H+)与NH3·H2O中的c(OH-)相等
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省肇庆市高二上学期期末考试化学试卷(解析版) 题型:填空题
(11分)甲醇可作电池的原料,也会造成环境污染。请根据有关反应回答问题。
(1)以CH4和H2O为原料,通过下列反应可制备甲醇。
①CH4(g)+H2O(g) CO(g)+3H2(g) △H =+206.0 kJ·mol-1
②CO(g)+2H2(g) CH3OH (g) △H=-129.0 kJ·mol-1
则CH4(g)+H2O(g) CH3OH (g)+H2(g)的△H= kJ·mol-1。
(2)将1.0 mol CH4(g)和2.0 mol H2O(g)通入容积为10 L的容器,在一定条件下发生反应①,测得在一定压强下CH4的转化率与温度的关系如图。设100℃时达到平衡所需的时间为5 min,
则这时间段v(H2)= mol·L-1·min-1。

(3)在一定温度下,将一定量CO和H2充入密闭容器发生反应②。达到平衡后,若压缩容器体积至原来的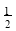 ,对平衡体系产生的影响是 (填序号)。
,对平衡体系产生的影响是 (填序号)。
①c ( H2 )减小 ②CH3OH 的物质的量增加 ③新平衡时, 减小,
减小,
④正反应速率加快,逆反应速率减慢 ⑤平衡常数K增大
(4)电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+氧化成Co3+,然后Co3+将甲醇氧化成CO2和H+(用石墨烯吸附除去Co2+)。现用下图装置模拟上述过程,则:

①Co2+在阳极的电极反应式为 ;
②请完成除去甲醇的离子方程式:Co3++CH3OH+ = Co2++CO2↑+6H+
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省广州市高一上学期期末考试化学试卷(解析版) 题型:实验题
(14分)实验题:
某实验小组拟验证CO2与Na2O2反应的产物,现设计以下实验装置进行实验:

(1)写出装置A中反应的化学方程式__________________________________;
写出装置B中反应的化学方程式__________________________________。
(2)拟用装置D收集气体产物,请在方框中将装置补充完整。

(3)产物检验:
①检验气体产物的方法:________________________________________;
检验固体产物的方法:从B装置中取少量固体,溶于水配成溶液,____________________________________________________________。
(4)有同学认为该实验装置存在明显缺陷,你认为该缺陷是什么____________。
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省广州市高一上学期期末考试化学试卷(解析版) 题型:选择题
以下关于混合物分离提纯操作或原理说法正确的是
A.实验室中用含有Ca2+、Mg2+、Cl-的自来水制取蒸馏水,可采用蒸馏的方法
B.用CCl4萃取碘水的实验中,振荡静置后,下层为紫红色溶液
C.利用植物油的密度比水小的原理,可用分液的方法分离这两种液体混合物
D.蒸馏时,温度计的水银球应充分接触溶液
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省广州市高一上学期期末考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.我国流通的硬币材质是金属单质
B.所有的不锈钢都只含有金属元素
C.黄铜的熔点高于金属铜,故应用广泛
D.镁合金的硬度和机械强度均高于纯镁
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省广州市五校高二上学期期末联考化学试卷(解析版) 题型:填空题
(14)CO2是最重要温室气体,如何降低大气中CO2的含量及有效地开发利用CO2具有重大意义。
(1)科学家用H2和CO2生产甲醇燃料。为探究该反应原理,进行如下实验:某温度下,在容积为2 L的密闭容器中充入1 mol CO2和3.5 mol H2,在一定条件下反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化关系如图所示。

①写出该反应的化学方程式_______________________计算从反应开始到3 min时,氢气的平均反应速率v(H2)=____________________。
②下列措施中一定能使CO2的转化率增大的是___________________ 。(双选、填序号)
A.在原容器中再充入1 mol H2 B.在原容器中再充入1 mol CO2
C.缩小容器的容积 D.使用更有效的催化剂
(2)科学家还利用氢气在一定条件下与二氧化碳反应生成乙醇燃料,其热化学反应方程式为:
2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g) ΔH=a kJ·mol-1,
CH3CH2OH(g)+3H2O(g) ΔH=a kJ·mol-1,
在一定压强下,测得该反应的实验数据如表所示。请根据表中数据回答下列问题。

①上述反应的a________0(填“大于”或“小于”)。
②恒温下,向反应体系中加入固体催化剂,则该反应的反应热a值____(填“增大”、“减小”或“不变”)。
在一定温度下,增大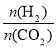 的值,CO2转化率_________,生成乙醇的物质的量________(填“增大”、“减小”、“不变”或“不能确定”)。
的值,CO2转化率_________,生成乙醇的物质的量________(填“增大”、“减小”、“不变”或“不能确定”)。
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省广州市五校高二上学期期末联考化学试卷(解析版) 题型:选择题
下列表述中,合理的是
A.把FeCl3的水溶液加热蒸干可得到FeCl3固体
B.用惰性电极电解足量的CuCl2溶液时,当有0.2 mol电子转移时阳极会析出6.4g铜
C.用25 mL碱式滴定管量取15.00mL 0.1000 mol·L-1酸性高锰酸钾溶液
D.将水加热,Kw增大,pH变小
查看答案和解析>>
科目:高中化学 来源:2014-2015学年云南省高三上学期期中考试化学试卷(解析版) 题型:选择题
下列表示对应化学反应的离子方程式正确的是
A.MnO2 与浓盐酸反应制Cl2: MnO2+4HCl Mn2++2Cl-+Cl2↑+2H2O
Mn2++2Cl-+Cl2↑+2H2O
B.明矾溶于水产生Al(OH)3 胶体: Al3++3H2O Al(OH)3↓+3H+
Al(OH)3↓+3H+
C.Na2O2 溶于水产生O2: Na2O2+H2O 2Na++2OH-+O2↑
2Na++2OH-+O2↑
D.Ca(HCO3)2溶液与少量NaOH溶液反应: HCO3-+Ca2++OH- CaCO3↓+H2O
CaCO3↓+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com