
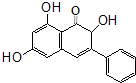
 高良姜素是姜科植物高良姜根中的提取物,它能使鼠伤寒沙门氏菌TA98和TA100发生诱变,具有抗病菌作用.下列关于高良姜素的叙述正确的是( )
高良姜素是姜科植物高良姜根中的提取物,它能使鼠伤寒沙门氏菌TA98和TA100发生诱变,具有抗病菌作用.下列关于高良姜素的叙述正确的是( )| A. | 高良姜素的分子式为C15H15O5 | |
| B. | 高良姜素分子中含有3个羟基、8个双键 | |
| C. | 高良姜素能与碳酸钠溶液、溴水、酸性高锰酸钾溶液等反应 | |
| D. | 1mol高良姜素与足量的钠反应生成33.6LH2 |
分析 有机物含有酚羟基、羰基、羟基和碳碳双键,结合苯酚、酮、醇以及烯烃的性质解答该题.
解答 解:A.由结构简式可知高良姜素的分子式为C15H12O5,故A错误;
B.分子含有两个苯环,只有1个碳碳双键,故B错误;
C.含有酚羟基,可与碳酸钠溶液反应、溴水反应,含有碳碳双键,可与溴水发生加成反应,可被酸性高锰酸钾氧化,故C正确;
D.含有3个羟基,但生成氢气存在的外界条件未知,不能确定体积大小,故D错误.
故选C.
点评 本题考查有机物的结构和性质,侧重于有机物的组成、结构和性质的考查,注意有机物空间结构特点的判断,把握有机物的官能团的种类和性质,为解答该题的关键,易错点为D,注意气体存在的外界条件的判断,题目难度不大.


科目:高中化学 来源: 题型:实验题
 ClO2是一种高效水处理剂,某实验小组用如图所示装置制取并收集ClO2.已知:
ClO2是一种高效水处理剂,某实验小组用如图所示装置制取并收集ClO2.已知:| 信息 | 内容 |
| ① | ClO2为黄绿色气体,极易溶于水,熔点为-59℃,沸点为11℃,具有强氧化性 |
| ② | ClO2易爆炸,若用惰性气体等稀释,则爆炸的可能性大降低 |
| ③ | HClO4、HClO2均是强酸,HClO4为无色透明液体,沸点为90℃;HClO2很不稳定,容易分解 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 15:8:1 | B. | 13:6:1 | C. | 9:6:1 | D. | 6:3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol苯分子中含有C═C键的数目为3NA | |
| B. | 含1molNa2CO3的溶液中,阴离子总数大于NA | |
| C. | 1molFeI2与足量氯气反应时转移的电子数为2NA | |
| D. | 标准状况下,22.4L空气中含有的氧原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |
 ;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,该反应的热化学方程式:SiCl4(g)+2H2(g)$\frac{\underline{\;高温\;}}{\;}$Si(s)+4HCl(g)△H=-0.025kJ/mol
;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,该反应的热化学方程式:SiCl4(g)+2H2(g)$\frac{\underline{\;高温\;}}{\;}$Si(s)+4HCl(g)△H=-0.025kJ/mol查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 4N2(g)+6H2O(g);△H
4N2(g)+6H2O(g);△H| 反应 | △H(kJ•mol-1) | 平衡常数(K) |
| 4NH3 (g)+5O2 (g)?4NO (g)+6H2O (g) | -905.5 | 1.1×1026mol•L-1 |
| 4NH3 (g)+4O2 (g)?2N2O (g)+6H2O (g) | -1104.9 | 4.4×1028 |
| 4NH3 (g)+3O2 (g)?2N2 (g)+6H2O (g) | -1269.0 | 7.1×1034L•mol-1 |
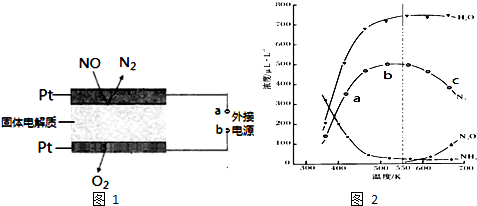
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由水电离出的c(H+)=10-13mol/L的溶液中可能存在:HCO3-、K+、Cl- | |
| B. | 酸性溶液中可能大量存在Na+、ClO-、I- | |
| C. | pH=l的溶液中的溶液中可以大量存在:K+、I-、NO3- | |
| D. | NH4Fe(SO4)2的溶液中一定可以存在:H+、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.5mol | B. | 1.8mol | C. | 3.3mol | D. | 3.6mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com