
| A. | 100g质量分数为46%的乙醇水溶液中氧原子数为4NA | |
| B. | lmolCl2通入水中,HC1O、Cl-、ClO-粒子数之和等于2NA | |
| C. | 标准状况下,2.24LD2中所含中子的数目是0.2NA | |
| D. | 25°C时,Ksp(BaSO4)=1×10-10,则 BaSO4饱和溶液中Ba2+浓度为 l×10-5mol•L-1 |
分析 A、乙醇溶液中,除了乙醇,水也含氧原子;
B、氯气和水的反应为可逆反应;
C、求出重氢的物质的量,然后根据重氢中含2个中子来分析;
D、BaSO4饱和溶液中c(Ba2+)•c(SO42-)=Ksp(BaSO4)=1×10-10,且c(Ba2+)=c(SO42-).
解答 解:A、乙醇溶液中,除了乙醇,水也含氧原子,而100g质量分数为46%的乙醇溶液中,含有的乙醇的物质的量为n=$\frac{100g×46%}{46g/mol}$=1mol,其中含1mol氧原子;而含有的水的物质的量为n=$\frac{100g-46g}{18g/mol}$=3mol,其中含3mol氧原子,故共含4mol氧原子即4NA个,故A正确;
B、氯气和水的反应为可逆反应,不能进行彻底,溶液中含未反应的氯气分子,故溶液中的HC1O、Cl-、ClO-粒子数之和小于2NA,故B错误;
C、标况下2.24L重氢的物质的量为0.1mol,而重氢中含2个中子,故0.1mol重氢中含0.2NA个中子,故C正确;
D、BaSO4饱和溶液中c(Ba2+)•c(SO42-)=Ksp(BaSO4)=1×10-10,且c(Ba2+)=c(SO42-),故有c(Ba2+)2=Ksp(BaSO4)=1×10-10,则c(Ba2+)=1×10-5mol/L,故D正确.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:选择题
| A. | “静电除尘”、“燃煤固硫”、“汽车尾气催化净化”都能提高空气质量 | |
| B. | 雾霾可能是许多细小液体小液滴和固体小颗粒分散到空气中形成的一种胶体 | |
| C. | 铝制餐具不宜用来蒸煮或长时间存放咸的食品 | |
| D. | 在食品袋中放入CaCl2•6H2O,可防止食物受潮 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 磷及其化合物在生产生活中的用途非常广泛.回答下列问题:
磷及其化合物在生产生活中的用途非常广泛.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 +
+ $\stackrel{△}{→}$
$\stackrel{△}{→}$
 b.
b. c.
c.
 .
. .
. .
. ,写出其合成路线:
,写出其合成路线: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为了防止富脂食品氧化变质,延长食品的保质期,常在包装袋中放入生石灰 | |
| B. | 实验室用带玻璃塞的试剂瓶保存氢氧化钠溶液 | |
| C. | 工业生产玻璃、水泥、漂白粉,均需要用石灰石为原料 | |
| D. | 可以利用氯化铁溶液的酸性清除铜镜表面的铜锈 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 性质 | 用途 |
| A | 糖类、油脂和蛋白质均能水解 | 供给人类营养 |
| B | 铁能被浓硫酸钝化 | 铁制器皿用作铜和浓硫酸的反应容器 |
| C | 碳单质的还原性强于硅单质 | 碳与石英反应冶炼粗硅 |
| D | 常温下,氨气能与氯气反应 | 浓氨水检验氯气管道泄漏 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
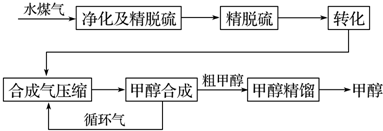
| 物质 | H2 | CO | CH3OH |
| 浓度/mol•L-1 | 0.2 | 0.1 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com