
| A. | 纳米铜是一种新型化合物 | |
| B. | 纳米铜颗粒比普通铜具有更强的化学活性 | |
| C. | 纳米铜粒子大小介于1~100 nm | |
| D. | 利用丁达尔现象可区别纳米铜和普通铜 |
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度,正反应速率增加,逆反应速率减小 | |
| B. | 升高温度有利于反应速率增加,从而缩短达到平衡的时间且提高A2的转化率 | |
| C. | 达到平衡后,同时升高温度和增大压强,有可能该平衡不发生移动 | |
| D. | 达到平衡后,降低温度或减小压强都有利于该平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑦⑩ | B. | ①④⑤⑦⑩ | C. | ①④⑤⑦⑧⑩ | D. | ④⑤⑦⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.58 g/L | B. | 0.29 g/L | C. | 1.16 g/L | D. | 0.714 g/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 mL 0.1 mol•L-1的氯化铝溶液 | B. | 20 mL 0.1 mol•L-1的氯化钙溶液 | ||
| C. | 30 mL 0.2 mol•L-1的氯化钾溶液 | D. | 40 mL 0.25 mol•L-1的氯化钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 488.3 kJ/mol | B. | -224.15 kJ/mol | C. | -488.3 kJ/mol | D. | 244.15 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
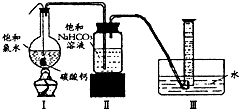 饱和氯水与石灰石的反应是制取较浓HClO溶液的方法之一.某《化学教育》杂志报道了如下实验研究:
饱和氯水与石灰石的反应是制取较浓HClO溶液的方法之一.某《化学教育》杂志报道了如下实验研究:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com