
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | Mg2+、NO3-、SO42-、Na+ | B. | K+、SO42-、HCO3-、Na+ | ||
| C. | NH4+、NO3-、Al3+、CH3COO- | D. | MnO4-、K+、SO42-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuSO4溶液 | B. | 盐酸 | C. | NaOH溶液 | D. | Ba(OH)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaH中H的化合价为-1价 | B. | H2O既不是氧化剂也不是还原剂 | ||
| C. | 该反应的离子方程式为:H-+H+═H2↑ | D. | NaOH是氧化产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
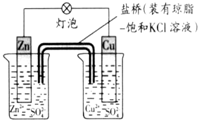
| A. | 正极反应为:Zn-2e-=Zn2+ | B. | Cu为负极,发生还原反应 | ||
| C. | 盐桥中的K+移向ZnSO4溶液 | D. | 在外电路中,电子从负极流向正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3- |
| 含量/mg?L-1 | 9360 | 83 | 200 | 1100 | 16000 | 1200 | 118 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应不一定伴随着能量的变化 | |
| B. | 氢气燃烧的热化学方程式为:2H2(g)+O2(g)═2H2O(g)△H=571.6kJ•mol-1 | |
| C. | 放在冰箱中的食品保质期较长,这与温度对反应速率的影响有关D.所有燃烧反应都是放热反应,所以不需吸收能量就可以进行 | |
| D. | 所有燃烧反应都是放热反应,所以不需吸收能量就可以进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com