
【题目】ClO2是一种消毒、杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得:(已知H2C2O4中的碳为+3价)2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2↑+2H2O。试回答下列问题。
(1)该反应中氧化产物的化学式是___________;被还原的元素是___________。
(2)用双线桥标出上述反应的电子转移情况______。
2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2↑+2H2O
(3)若反应共产生了4.48L气体(标准状况),则反应转移电子的物质的量为_________mol,消耗还原剂的物质的量为___________mol。
(4)标准状况下44.8mL的ClO2气体恰好能与50mL 0.1mol·L-1的Na2SO3溶液液完全反应,生成Na2SO4,氯元素在产物中的化合价为___________;此过程说明ClO2具有____(填“氧化”或“还原”)性。
【答案】 CO2 Cl  0.1 0.05 氧化 -1
0.1 0.05 氧化 -1
【解析】(1)反应中碳元素化合价从+3价升高到+4价,失去电子,草酸是还原剂,CO2是该反应中氧化产物;氯元素化合价从+5价降低到+4价,得到电子,被还原的元素是Cl。(2)根据以上分析可知用双线桥标出该反应的电子转移情况为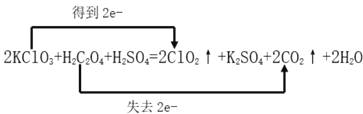 ;(3)若反应共产生了4.48L气体(标准状况),气体的物质的量是4.48L÷22.4L/mol=0.2mol,根据方程式可知CO2是0.1mol,则反应转移电子的物质的量为0.1mol,消耗还原剂的物质的量为0.1mol÷2=0.05mol。(4)44.8mL的ClO2气体的物质的量是0.0448L÷22.4L/mol=0.002mol。设氯元素在产物中的化合价为n,则根据电子得失守恒可知0.002mol×(4-n)=0.05L×0.1mol/L×(6-4),解得n=-1,即氯元素在产物中的化合价为-1价,氯元素化合价降低,得到电子,这说明ClO2具有氧化性。
;(3)若反应共产生了4.48L气体(标准状况),气体的物质的量是4.48L÷22.4L/mol=0.2mol,根据方程式可知CO2是0.1mol,则反应转移电子的物质的量为0.1mol,消耗还原剂的物质的量为0.1mol÷2=0.05mol。(4)44.8mL的ClO2气体的物质的量是0.0448L÷22.4L/mol=0.002mol。设氯元素在产物中的化合价为n,则根据电子得失守恒可知0.002mol×(4-n)=0.05L×0.1mol/L×(6-4),解得n=-1,即氯元素在产物中的化合价为-1价,氯元素化合价降低,得到电子,这说明ClO2具有氧化性。


科目:高中化学 来源: 题型:
【题目】在强碱性溶液中,可以大量共存的离子组是( )
A.K+、SO42﹣、CO32﹣
B.NH4+、Na+、SO42﹣
C.Mg2+、HCO3﹣、Cl﹣
D.Ag+、Al3+、Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合溶液中所含离子的浓度如下表,则M离子可能为( )
所含离子 | Cl- | SO42- | H+ | M |
浓度 /(mol·L-1) | 2 | 1 | 2 | 1 |
A. Na+ B. Fe3+ C. NO3- D. Mg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.4 mol·L-1NaOH溶液450 mL
(1)配制上述溶液选用的主要玻璃仪器除烧杯、玻璃棒、胶头滴管外还需用到的玻璃仪器是____________(填仪器名称)。
(2)根据计算用托盘天平称取NaOH的质量为 _________g,在实验中其他操作均正确,若容量瓶用蒸馏水洗涤后没有干燥就开始移液,则所得溶液浓度 _____ 0.4 mol·L-1(填“大于”“等于”或“小于”,下同);若NaOH溶液在转移至容量瓶时未经冷却,则所得溶液浓度_____0.4mol·L-1;若定容时俯视液面,则所得溶液浓度_____0.4mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砹是原子序数最大的卤族元素,推测砹及其化合物最不可能具有的性质是( )
A. 砹是白色固体 B. HAt 很不稳定
C. AgAt 不溶于水 D. 砹易溶于某些有机溶剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气与有关物质反应的实验现象记录不正确的是 ( )
A. 钠可以在氯气中燃烧,产生白色的烟
B. 红热的铁丝可以在氯气中燃烧,产生绿色的烟
C. 纯净的氢气可以在氯气中安静地燃烧,火焰苍白色
D. 常温下 1 体积水可以溶解 2 体积氯气,得到氯水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为1.00L的容器中,通入一定量的N2O4 , 发生反应N2O4(g)2NO2(g),随温度的升高,混合气体的颜色变深.
回答下列问题:
(1)反应的△H0(填“大于”或“小于”);100℃时,体系中各物质浓度随时间变化如图所示.在0~60s时段,反应速率v(N2O4)为molL﹣1s﹣1;反应的平衡常数K1为 .
(2)100℃时达平衡后,改变反应温度为T,c(N2O4)以0.0020molL﹣1s﹣1的平均速率降低,经10s又达到平衡.
①T100℃(填“大于”或“小于”),判断理由是 .
②列式计算温度T时反应的平衡常数K2 .
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向(填“正反应”或“逆反应”)方向移动,判断理由是 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。
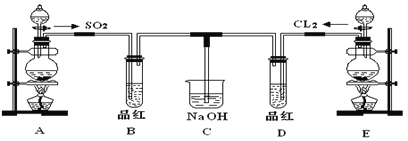
(1)实验室用装置A制备SO2。某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未流下,你认为原因可能是:________________________________________________________
(2)实验室用装置E制备CL2,其反应的化学化学方程式为:MnO2+4HCl(浓)==MnCl2+Cl2 ↑ +2H2O请指出该反应中的液体反应物在反应中所表现出的化学性质:_______________________________________。
(3)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:B:________________________________,D:____________________________。
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为B:________________________________,D:____________________________。
(4)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强,他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示)_____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com