
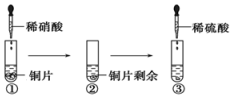
| A. | ①中溶液呈蓝色,试管口有红棕色气体产生,稀硝酸被还原为NO2 | |
| B. | ②中溶液存在:c(Cu2+)+c(H+)=c(NO3-)+c(OH-) | |
| C. | 由上述实验得出结论:常温下,Cu既可与稀硝酸反应,也可与稀硫酸反应 | |
| D. | ③中反应的化学方程式:3Cu+Cu(NO3)2+4H2SO4═4CuSO4+2NO↑+4H2O |
分析 由实验可知,①中发生3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O,②中观察到Cu剩余,则硝酸完全反应,③中加稀硫酸,Cu与稀硫酸不反应,但硝酸铜在酸性条件下具有硝酸的强氧化性,继续与Cu反应,以此来解答.
解答 解:A.①中发生3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O,生成硝酸铜溶液为蓝色,试管口NO被氧化生成红棕色的二氧化氮,但硝酸被还原生成NO,故A错误;
B.②中溶液存在电荷守恒为:2c(Cu2+)+c(H+)=c(NO3-)+c(OH-),故B错误;
C.由上述实验可得出结论:Cu在常温下可以和稀硝酸反应,但不能与稀硫酸反应,故C错误;
D.实验③发生反应的化学方程式为:3Cu+Cu(NO3)2+4H2SO4═4CuSO4+2NO↑+4H2O,故D正确;
故选D.
点评 本题考查化学实验方案的评价、Cu和硝酸的性质,把握发生的反应及现象、结论的关系为解答的关键,侧重分析与实验能力的考查,注意硝酸盐在酸性条件下的性质,题目难度不大.


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:选择题
| A. | 溶液中一定含有H+、SO42- | B. | 溶液中一定没有OH-、Fe2+、NO3- | ||
| C. | 溶液中可能含有Na+、Fe2+、Ba2+ | D. | 一定有H2生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 甲是一种太阳能电池的工作原理示意图,电解质为K3[Fe(CN)6]和K4[Fe(CN)6]的混合溶液,将甲装置和乙装置相连实现铁件上镀铜.下列说法正确的是( )
甲是一种太阳能电池的工作原理示意图,电解质为K3[Fe(CN)6]和K4[Fe(CN)6]的混合溶液,将甲装置和乙装置相连实现铁件上镀铜.下列说法正确的是( )| A. | 电池工作时,K+移向电极a | |
| B. | 电极b表面发生的电极反应Fe(CN)64--e-═Fe(CN)63- | |
| C. | Cu电极应与Y相连接,发生氧化反应 | |
| D. | 工作一段时间后,甲乙两装置中电解质溶液浓度均变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作 | 现象 | 结论 |
| A | 向二氧化锰固体中加入浓盐酸后加热,将产生的气体通入淀粉碘化钾溶液液 | 溶液变蓝 | Cl2具有氧化性 |
| B | 向亚硫酸钠固体中加入浓硫酸,将产生的气体通入溴水 | 溴水褪色 | SO2具漂白性 |
| C | 向蔗糖溶液中加稀硫酸,水浴加热后,加入新制氢氧化铜,加热 | 溶液变蓝 | 蔗糖水解产物没有还原性 |
| D | 无水乙醇与浓硫酸共热170℃,将产生的气体通入酸性高锰酸钾溶液 | 溶液褪色 | 乙烯可被化酸性高锰酸钾氧化 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 收集氯气用排饱和食盐水的方法 | |
| B. | 加压条件下有利于SO2和O2反应生成SO3 | |
| C. | 将NO2球浸泡在热水中颜色加深 | |
| D. | 加催化剂,使N2和H2在一定的条件下转化为NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 2mL 0.1mol/L的NaOH溶液中滴加2滴0.1mol/L的MgCl2溶液,再滴加2滴0.1mol/L的FeCl3溶液 | 白色沉淀变为红褐色 | Ksp[Mg(OH)2]>Ksp[Fe(OH)3] |
| B | 常温下,质量与表面积均相同的铝片分别投入足量的稀、浓硫酸中 | 浓硫酸中铝片先溶解完 | 反应物浓度越大,反应速率越快 |
| C | 将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡、静置 | 下层溶液显紫红色 | 氧化性:Fe3+>I2 |
| D | 向Na2SO3溶液加入稀盐酸酸化的Ba(NO3)2溶液 | 产生白色沉淀 | Na2SO3溶液已变质 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质 | |
| B. | 生活中常见金属镁、铝、铁、铜等均能通过热还原法冶炼 | |
| C. | 胶体具有介稳性,是因为同种胶体粒子的运动有规律,即布朗运动 | |
| D. | 由于2NO+2CO?2CO2+N2的△H<0,则该反应一定能自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com