


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:
| A、一定有甲烷 |
| B、一定有丙烯 |
| C、一定有乙炔 |
| D、一定有乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.50mol/L |
| B、0.60mol/L |
| C、0.45mol/L |
| D、0.55mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
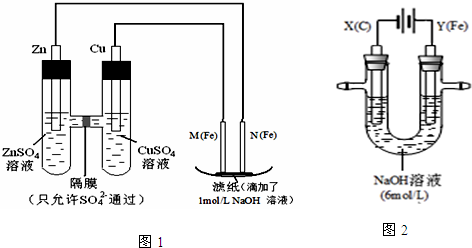
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、△H1=△H2 |
| B、△H1>△H2 |
| C、△H1<△H2 |
| D、无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
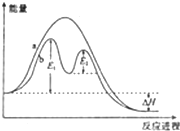
| A、反应过程b有催化剂参与 |
| B、该反应为放热反应,热效应等于△H |
| C、加入催化剂,可改变该反应的活化能 |
| D、有催化剂的条件下,反应的活化能等于E1+E2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com