
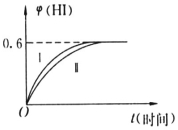
 将1molI2(g)和2molH2(g)置于某2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)?2HI(g)△H<0,并在10min时达到平衡.HI的体积分数φ(HI)随时间变化如图所示曲线(Ⅱ).
将1molI2(g)和2molH2(g)置于某2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)?2HI(g)△H<0,并在10min时达到平衡.HI的体积分数φ(HI)随时间变化如图所示曲线(Ⅱ).分析 (1)当化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再发生变化,由此衍生的一些物理性不变;
(2)达到平衡状态下HI(g)表示的反应速率v=$\frac{△c}{△t}$,转化率=$\frac{消耗量}{起始量}$×100%;
(3)平衡常数K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$;若保持温度、体积不变,向已平衡的体系中再充入I2(g)和HI(g)各1mol,计算浓度商和平衡常数比较判断反应进行的方向;
(4)该反应是一个反应前后气体体积不变的可逆反应,改变条件时,该反应中HI的体积分数不变,说明改变体积平衡不移动,改变条件时到达平衡的时间缩短,说明加快反应速率,改变的条件可能是增大压强、加入催化剂;
(5)运用等效平衡判断,恒温恒容,前后气体体积不变化,按化学计量数转化到左边,满足与原来加入的反应物物质的量比例相等即可.
解答 解:(1)I2(g)+H2(g)?2HI(g)△H<0,反应为气体体积不变的放热反应,
A.反应前后气体质量和体积不变,混合气体密度不再变化不能说明反应达到平衡状态,故A错误;
B.反应混合物中H2的浓度不变是平衡标志,故B正确;
C.混合气体中碘蒸气有颜色,混合气体的颜色不再变化,说明碘单质浓度不变,反应达到平衡状态,故C正确;
D.每消耗1molH2同时消耗1molI2 反应正向进行,不能说明反应达到平衡状态,故D错误;
故答案为:B C;
(2)将1molI2(g)和2molH2(g)置于某2L密闭容器中,在一定温度下发生反应,并在10min时达到平衡,设反应碘单质物质的量x,
I2(g)+H2(g)?2HI(g)△H<0,
起始量(mol) 1 2 0
变化量(mol) x x 2x
平衡量(mol) 1-x 2-x 2x
碘化氢体积分数0.6,$\frac{2x}{3}$=0.6
x=0.9mol,
在达平衡过程中用HI(g)表示的反应速率=$\frac{\frac{2xmol}{2L}}{10min}$=0.09 mol•L-1•min-1,
I2(g)的平衡转化率=$\frac{0.9mol}{1mol}$×100%=90%,
故答案为:0.09 mol•L-1•min-1; 90%;
(3)依据(2)计算结果计算得到平衡浓度c(H2)=$\frac{1.1mol}{2L}$=0.55mol/L,c(I2)=$\frac{0.1mol}{2L}$=0.05mol/L,c(HI)=$\frac{2×0.9mol}{2L}$=0.9mol/L,
平衡常数K=$\frac{0.{9}^{2}}{0.55×0.05}$=29.5,若保持温度、体积不变,向已平衡的体系中再充入I2(g)和HI(g)各1mol,
平衡浓度c(H2)=0.55mol/L,c(I2)=$\frac{1-0.9+1}{2}$mol/L=0.55mol/L,c(HI)=$\frac{1.8+1}{2}$=1.4mol/L
Qc=$\frac{1.{4}^{2}}{0.55×0.55}$=6.49<K=29.5,平衡正向进行,平衡向右移动,
故答案为:29.5;向右移动;
(4)φ(HI)的变化如曲线(Ⅰ) 所示,反应时间缩短,碘化氢的含量不变,说明该条件只增大了反应速率不影响平衡,增大压强和加入催化剂对该反应平衡无影响,但都增大反应速率,缩短反应时间,
①恒容条件下,降低温度,反应速率减小,达到平衡所需时间变长,平衡变化,故①错误;
②恒温条件下,缩小反应容器体积,增大压强,反应速率增大,反应前后气体体积不变平衡不变,故②正确;
③恒温条件下,扩大反应容器体积,压强减小,反应速率减小,故③错误;
④恒温、恒容条件下,加入适当催化剂,加快反应速率,平衡不变,故④正确,
故答案为:②④;
(5)若保持温度不变,在另一个相同的2L密闭容器中加入a mol I2(g)、b mol H2(g)和c mol HI(a、b、c均大于0),发生反应,达平衡时,HI的体积分数仍为0.6,与原来的平衡是等效平衡,恒温恒容,前后气体体积不变化,按化学计量数转化到左边,满足与原来加入的反应物物质的量比例相等即可;
对于反应 I2(g)+H2(g)?2HI(g);
开始(mol):a b c
变化(mol):$\frac{1}{2}$c $\frac{1}{2}$c c
平衡(mol):a+$\frac{1}{2}$c b+$\frac{1}{2}$c 0
则(a+$\frac{1}{2}$c ):( b+$\frac{1}{2}$c)=1:2,
所以4a+c=2b,
故答案为:4a+c=2b.
点评 本题考查了反应速率的计算以及物质的量浓度、外界条件对化学反应平衡移动的影响等知识点,根据原子守恒计算平衡时碘的浓度,再结合图象中反应时间、HI的体积分数确定改变条件,注意:无论放热反应还是吸热反应,温度都改变化学平衡移动,为易错点,题目难度中等;


科目:高中化学 来源: 题型:解答题
 已知某反应A(g)+B(g)?C(g)+D(g),反应过程中的能量变化如图所示,回答下列问题.
已知某反应A(g)+B(g)?C(g)+D(g),反应过程中的能量变化如图所示,回答下列问题.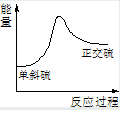
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某化学课外兴趣小组为探究铜与浓硫酸反应气体产物的性质,拟用如图所示的装置的组合进行实验.
某化学课外兴趣小组为探究铜与浓硫酸反应气体产物的性质,拟用如图所示的装置的组合进行实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| A | B | ||
| D | E | G | J |
| L | M | Q |
 .写出一个能表示元素G、J非金属性强弱关系的化学方程式H2S+Cl2=2HCl+S↓或Na2S+Cl2=2NaCl+S↓.
.写出一个能表示元素G、J非金属性强弱关系的化学方程式H2S+Cl2=2HCl+S↓或Na2S+Cl2=2NaCl+S↓.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
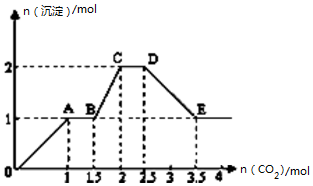 现有易溶强电解质的混合溶液10L,其中可能含存K+、Ba2+、Na+、NH4+、Cl-、SO42-、AlO2-、OH-中的几种,向其中通入CO2气体,产生沉淀的量与通入CO2的量之间的关系如图所示,下列说法正确的是( )
现有易溶强电解质的混合溶液10L,其中可能含存K+、Ba2+、Na+、NH4+、Cl-、SO42-、AlO2-、OH-中的几种,向其中通入CO2气体,产生沉淀的量与通入CO2的量之间的关系如图所示,下列说法正确的是( )| A. | 该溶液中能确定存在的离子是 Ba2+、AlO2-、NH4+ | |
| B. | 肯定不存在的离子是SO42-、OH- | |
| C. | 若不能确定的离子中至少还存在一种阳离子,则该离子的最小浓度为0.2mol/L | |
| D. | OA 段反应的离子方程式:2 AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com