
用惰性电极电解下列物质的溶液,一段时间后,再加入一定质量的另一种物质(括号内),溶液能与原来溶液完全相同的是( )
A.CuCl2[CuO] B.NaOH[Na2O] C.NaCl[HCl] D.CuSO4[Cu(OH)2]
科目:高中化学 来源: 题型:
下列说法不正确的是( )
|
| A. | 金属腐蚀就是金属原子失去电子被氧化的过程 |
|
| B. | 钢铁吸氧腐蚀时,正极反应式为:2H2O+O2+4e﹣=4OH﹣ |
|
| C. | 氯碱工业中,阳极发生的反应为:2Cl﹣﹣2e﹣=Cl2↑ |
|
| D. | 镀锌铁皮的镀层损坏后,铁更容易腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
|
|
|
|
|
|
|
| |||||||
| |||||||
 | |||||||
|
(1)器材已有:滤纸、铁架台、铁圈和烧杯,还要补充的玻璃仪器是(填名称) 。
(2)由滤液A制得AlCl3溶液有途径I和Ⅱ两条,你认为合理的是____________。
写出A经途径Ⅱ生成D的离子方程式 。
(3)从滤液E中硫酸得到绿矾晶体的实验操作是 。
(4)写出用滤渣F制备CuSO4溶液的化学方程式(要求节约,环保)
(5)有同学提出可将方案中最初溶解合金的烧碱改用盐酸,重新设计方案,也能制得三种物质,你认为后者的方案是否更合理 ,理由是
查看答案和解析>>
科目:高中化学 来源: 题型:
将下图所示实验装置的K闭合,下列判断正确的是
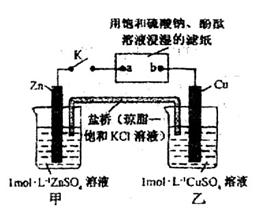
A.Cu电极上发生还原反应
B.电子沿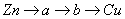 路径流动
路径流动
C.片刻后甲池中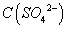 增大
增大
D.片刻后可观察到滤纸b点变红色
查看答案和解析>>
科目:高中化学 来源: 题型:
氨气是一种重要的化工产品及工业原料。
I.某温度下,合成氨反应的平衡常数K=3.0×103(mol/L)-1,
(1)写出其对应的化学方程式____________________________________________________ 。
(2)某温度下,如果在体积恒定为10L的密闭容器中充入:0.1molN2、0.1molH2和2molNH3则反应_______(填“正向进行”或“逆向进行”或“达到平衡”)。
(3)该温度下,在体积恒定为10L的四个密闭容器中分别充入下列物质,反应达到平衡后,N2的转化率最大的是___________________。
a.10molN2、30molH2和20molNH3 b.10molN2和30molH2
c.20molN2和60molH2 d.10molN2和28molH2
II.氨气极易溶于水,氨水是氨气溶于水而形成的溶液,回答下列问题:
(4)在氨水溶液中加水稀释的过程,NH3·H2O的电离程度___________(填“增大”“减小”或“不变”), ___________(同上)。
___________(同上)。
(5)室温下,a mol/L的(NH4)2SO4水溶液的pH=5,原因是溶液中存在平衡________________________(用离子方程式表示)。并计算该平衡的平衡常数表达式为________________________(用含代数a的较为精确的数学表达式表示,不必化简,不做近似运算)。
(6)室温下,向浓度均为0.1mol/L的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为_________________________________________。
(已知:室温时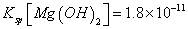 mol3
mol3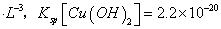 mol3.L-3).
mol3.L-3).
查看答案和解析>>
科目:高中化学 来源: 题型:
有四种燃料电池:A.固体氧化物燃料电池,B.碱性氢氧化物燃料电池,C.质子交换膜燃料电池,D.熔融盐燃料电池,下面是工作原理示意图,其中正极反应生成水的是( )
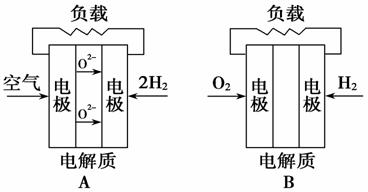
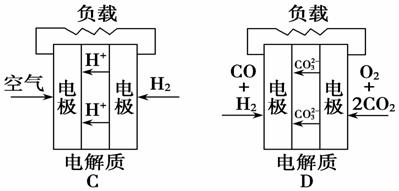
查看答案和解析>>
科目:高中化学 来源: 题型:
用FeCl3酸性溶液脱除H2S后的废液,通过控制电压电解得以再生。某同学使用石墨电极,在不同电压(x)下电解pH=1的0.1mol/L的FeCl2溶液,研究废液再生机理。记录如下(a、b、c代表电压数值):
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| I | x≥a | 电极附近出现黄色,有气泡产生 | 有Fe3+、有Cl2 |
| II | a>x≥b | 电极附近出现黄色,无气泡产生 | 有Fe3+、无Cl2 |
| III | b>x>0 | 无明显变化 | 无Fe3+、无Cl2 |
(1)用KSCN检验出Fe3+的现象是_______________________。
(2)I中,Fe3+产生的原因可能是Cl—在阳极放电,生成的Cl2将Fe2+氧化。写出有关反应:
____________________________________________________。
(3)由II推测,Fe3+产生的原因还可能是Fe2+在阳极放电,原因是Fe2+具有_________性。
(4)II中虽未检验出Cl2,但Cl—在阳极是否放电仍需进一步验证。电解pH=1的NaCl溶液做对照实验,记录如下:
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| IV | a>x≥c | 无明显变化 | 有Cl2 |
| V | c>x≥b | 无明显变化 | 无Cl2 |
①NaCl的浓度是_________mol/L
②IV中检测Cl2的实验方法______________________________________________。
③与II对比,得出的结论(写出两点):_____________________________________________。
(5)能量之间可以相互转化:电解食盐水制备Cl2是将电能转化为化学能,而原电池可将
化学能转化为电能。设计两种类型的原电池,探究其能量转化效率。
限选材料:ZnSO4(aq),FeSO4(aq),CuSO4(aq);铜片,铁片,锌片和导线。
完成原电池的装置示意图(见图15),并作相应标注。
要求:在同一烧杯中,电极与溶液含相同的金属元素。
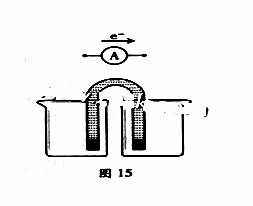
铜片为电极之一,CuSO4(aq)为电解质溶液,只在一个烧杯中组装原电池乙,工作一段时间后,可观察到负极 。
根据牺牲阳极的阴极保护法原理,为减缓电解质溶液中铁片的腐蚀,在(5)的材料中应选 作阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
标准状况下将 aL HCl气体溶于bmL水中,得到的盐酸溶液密度为c g·cm-3,则该溶液中溶质的物质的量的浓度可表示为( )
A.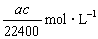 B.
B.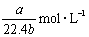
C.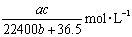

 D.
D.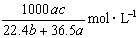
查看答案和解析>>
科目:高中化学 来源: 题型:
2004年2月22日是第35个 “世界地球日”,我国确定的主题是“善待地球——科学发展”。下列行为中不符合这一主题的是( )
A.采用“绿色化学”工艺,使原料尽可能转化为所需要的物质
B.减少直至不使用对大气臭氧层起破坏作用的氟氯烃
C.大量开采地下水,以满足社会对水的需求
D.节约能源,提高能源利用率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com