
【题目】有机物Ⅰ(英文名为Esmolol)是治疗快速室上性心律失常、急性心肌缺血、术后高血压等的理想药物,Esmolol的合成路线如图:

已知: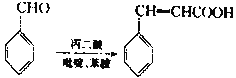
回答下列问题:
(1)C中官能团的名称有____。
(2)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。则有机物Ⅰ中的手性碳数目有____个。
(3)G→H的反应类型为____;B→C反应需要的试剂和条件为____。
(4)C→D中步骤①反应的化学方程式为_____。
(5)E的结构简式为____。
(6)X是F的同分异构体,则满足下列条件的X的结构有___种。
①能发生水解反应和银镜反应;
②能与FeCl3溶液发生显色反应,且苯环上有三个取代基。
(7)参照上述合成路线,设计以 、CH3OH和
、CH3OH和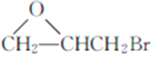 为主要原料制备
为主要原料制备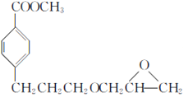 的合成路线。______
的合成路线。______
【答案】酯基、氯原子 1 取代反应 氯气,光照  +4NaOH
+4NaOH![]()
![]() +2NaCl+CH3COONa+2H2O
+2NaCl+CH3COONa+2H2O 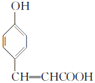 20
20 
![]()
![]()

![]()

【解析】
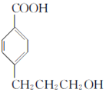
根据流程图可知C7H8O为对甲基苯酚(![]() ),与乙酸(CH3COOH)反应生成B,B为
),与乙酸(CH3COOH)反应生成B,B为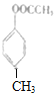 ,根据C的结构可知,B在光照条件下与氯气发生取代反应生成C(
,根据C的结构可知,B在光照条件下与氯气发生取代反应生成C(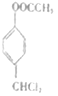 ),结合反应条件,C在氢氧化钠水溶液中反应后酸化得到D(C7H6O2),则D为
),结合反应条件,C在氢氧化钠水溶液中反应后酸化得到D(C7H6O2),则D为![]() ,结合信息可知,
,结合信息可知,![]() 反应生成E,E为
反应生成E,E为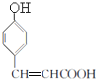 ;E在催化剂作用下与氢气加成生成F,F为
;E在催化剂作用下与氢气加成生成F,F为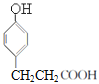 ,F在浓硫酸存在时与甲醇发生酯化反应生成G,G为
,F在浓硫酸存在时与甲醇发生酯化反应生成G,G为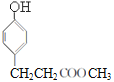 ,根据H的结构可知,G与
,根据H的结构可知,G与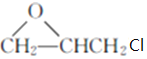 发生取代反应生成H,加成分析解答。
发生取代反应生成H,加成分析解答。
(1)C( )中官能团有酯基、氯原子,故答案为:酯基、氯原子;
)中官能团有酯基、氯原子,故答案为:酯基、氯原子;
(2)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。有机物Ⅰ(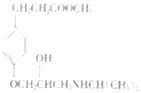 )中的手性碳有1个(
)中的手性碳有1个(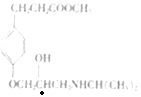 标记“●”的为手性碳),故答案为:1;
标记“●”的为手性碳),故答案为:1;
(3)根据流程图,结合G和H的结构可知,G→H发生取代反应;B→C反应需要的试剂和条件为氯气,光照,故答案为:取代反应;氯气,光照;
(4)C→D中步骤①为氯原子和酯基的水解反应,反应的化学方程式为 +4NaOH
+4NaOH![]()
![]() +2NaCl+CH3COONa+2H2O,故答案为:
+2NaCl+CH3COONa+2H2O,故答案为: +4NaOH
+4NaOH![]()
![]() +2NaCl+CH3COONa+2H2O;
+2NaCl+CH3COONa+2H2O;
(5)根据上述分析,E为 ,故答案为:
,故答案为: ;
;
(6)X是F( )的同分异构体,①能发生水解反应和银镜反应,说明结构中存在醛基和酯基;②能与FeCl3溶液发生显色反应,说明含有酚羟基,且苯环上有三个取代基。满足条件的X有:①苯环上含有羟基、甲基和HCOOCH2-,有10种结构;②苯环上含有羟基、乙基和HCOO-,有10种结构;共20种,故答案为:20;
)的同分异构体,①能发生水解反应和银镜反应,说明结构中存在醛基和酯基;②能与FeCl3溶液发生显色反应,说明含有酚羟基,且苯环上有三个取代基。满足条件的X有:①苯环上含有羟基、甲基和HCOOCH2-,有10种结构;②苯环上含有羟基、乙基和HCOO-,有10种结构;共20种,故答案为:20;
(7)将 分解为
分解为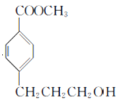 和
和![]() ,再结合原料
,再结合原料 即可设计合成路线:
即可设计合成路线:
![]()

![]()

![]()
 ,故答案为:
,故答案为:
![]()

![]()

![]()
 。
。


科目:高中化学 来源: 题型:
【题目】乙醇是制取饮料、香精、染料、涂料、洗涤剂等产品的原料.
完成下列填空:
(1)实验室用乙醇制取乙烯时,浓硫酸的用量远远超过作为催化剂的正常用量,原因是______.
(2)验证乙烯加成反应性质时,需对乙烯气体中的干扰物质进行处理,可选用的试剂是______(填写化学式);能确定乙烯通入溴水中发生了加成反应的事实是______.(选填编号)
a.溴水褪色 b.有油状物质生成
c.反应后水溶液酸性增强 d.反应后水溶液接近中性
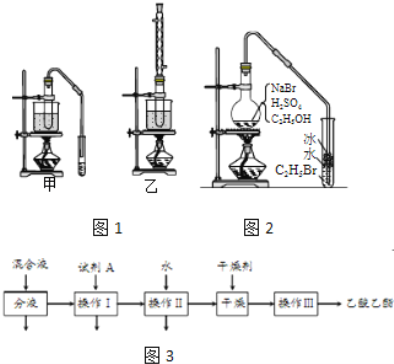
(3)实验室用乙醇和乙酸制备乙酸乙酯时,甲乙两套装置如图1都可以选用.关于这两套装置的说法正确的是______.(选填编号)
物质 | 沸点(℃) |
乙醇 | 78.5 |
乙酸 | 117.9 |
乙酸乙酯 | 77 |
a.甲装置乙酸转化率高 b.乙装置乙酸转化率高
c.甲装置有冷凝回流措施 d.乙装置有冷凝回流措施
(4)用乙装置实验时,提纯乙中乙酸乙酯的流程如图3,以上流程中试剂A的化学式是______;操作Ⅱ的名称是______;操作Ⅲ一般适用于分离______混合物.
(5)如图2是用乙醇制备溴乙烷的装置,实验中有两种加料方案:
①先加溴化钠→再加乙醇→最后加1:1浓硫酸;
②先加溴化钠→再加1:1浓硫酸→最后加乙醇.
按方案①和②实验时,产物都有明显颜色,若在试管中加入______,产物可变为无色.与方案①相比较,方案②的明显缺点是______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)对于反应2SiHCl3(g)===SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。

①343 K时反应的平衡转化率α=________%。平衡常数K343 K=________(保留2位小数)。
②在343 K下:要提高SiHCl3转化率,可采取的措施是________;要缩短反应达到平衡的时间,可采取的措施有________、________。
③比较a、b处反应速率大小:va________vb(填“大于”“小于”或“等于”)。反应速率v=v正-v逆=k正x2SiHCl3-k逆xSiH2Cl2xSiCl4,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算a处的v正/v逆=________(保留1位小数)。
(2)不同温度下水的离子积常数如表所示:
t/℃ | 0 | 10 | 20 | 25 | 40 | 50 | 100 |
Kw/10-14 | 0.114 | 0.292 | 0.681 | 1.01 | 2.92 | 5.47 | 55.0 |
①请用文字解释随温度升高水的离子积增大的原因_______________;
②10℃时纯水的电离平衡常数为_________;计算100℃时纯水中电离产生的氢离子浓度为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为发光二极管连接柠檬电池装置,下列说法正确的是
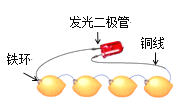
A. 铁环作为柠檬电池的正极
B. 电子由发光二极管经导线流向Fe环
C. 负极的电极反应为:Fe-2 e-===Fe2+
D. 可将柠檬替换成盛装酒精溶液的装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于离子共存或化学用语的表述正确的是
A. 由水电离出的c(H+)=1.0×10-12 molL1的溶液中可能大量存在:Na+、K+、SO32-、HCO3-
B. 常温下,c(OH-)/c(H+)=1.0×1012的溶液中可能大量存在NH4+、Na+、Cl-、NO3-
C. 硫酸氢钠溶于水的电离方程式为:NaHSO4=Na++H++SO42-
D. 碳酸钠溶液呈碱性的原因:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20mL0.1000mol·L-1氨水用0.1000mol·L-1的盐酸滴定,滴定曲线如图,下列说法正确的是( )
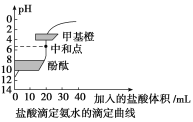
A.该中和滴定适宜用酚酞作指示剂
B.两者恰好中和时,溶液的pH=7
C.达到滴定终点时,溶液中:c(H+)=c(OH-)+c(NH3·H2O)
D.当滴入盐酸达30 mL时,溶液中c(NH4+)+c(H+)<c(OH-)+c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)利用I2O5可使CO与H2O(g)反应转化为CO2和H2,从而有效减少大气污染。该过程可通过图1所示的两步反应循环实现。
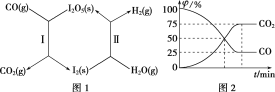
其中:反应Ⅰ为I2O5(s)+5CO(g)=I2(s)+5CO2(g) ΔH=a kJ·mol-1
反应Ⅱ中,生成1 mol H2(g)时,反应热ΔH=b kJ·mol-1。
①总反应的热化学方程式为(反应热ΔH用含a、b的代数式表示)______。
②在恒温密闭容器中加入一定量的CO(g)和I2O5(s),发生反应Ⅰ并达到平衡。测得体系中各气体组分的体积分数φ随时间t的变化如图2所示。则此反应用气体分压表示的平衡常数Kp=______(已知:气体分压=气体总压×体积分数)。
(2)已知铅盐中,Pb(NO3)2、(CH3COO)2Pb易溶于水,PbSO4、PbS难溶于水,室温下其溶度积常数为Ksp(PbSO4)=1.06×10-8;Ksp(PbS)=3.40×10-28。
①将一定量的PbSO4加入足量饱和CH3COONH4溶液中,微热,并不断搅拌,因发生复分解反应,PbSO4缓慢溶解。能发生此复分解反应的原因是______。
②某溶液中主要含有S2-、SO42-等阴离子,向其中滴加Pb(NO3)2溶液,当PbSO4开始析出时,溶液中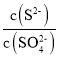 =________。
=________。
(3)钛基二氧化铅(Ti/PbO2)是重要的电极材料,工业上用电解法制作,主要流程如图:
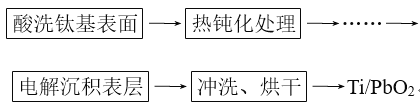
其中“电解沉积表层”是制作的关键,方法是电解可溶性铅盐溶液,使生成的PbO2沉积在阳极金属钛(Ti)上。主反应为2Pb2++2H2O=Pb+PbO2+4H+。
①必须预先将阳极金属钛进行“热钝化处理”,原因是_______。
②电解槽中,阳极主要的反应式为___;该法的缺点是阳极、阴极均会发生副反应。其中阴极上产生的气体副产物是____。
③电解法制得的PbO2晶体中含有少量的+2价铅,从而导致氧原子所在位置出现少量“空穴”(即化学式为PbOx,但x<2)。若电解时每生成1molPbOx转移1.94NA个e-(NA为阿伏加德罗常数的值),则铅元素中+2价铅所占的质量分数为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将有机物完全燃烧,生成CO2和H2O,将12 g该有机物完全燃烧产物通过浓硫酸,浓硫酸增重14.4 g,再通过碱石灰,又增重26.4 g。则该有机物的分子式为( )
A. C4H10 B. C2H6O
C. C3H8O D. C2H4O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com