
 过氧化氢的电子式
过氧化氢的电子式
 ,其最高价氧化物对应的水化物的化学式为HClO4.
,其最高价氧化物对应的水化物的化学式为HClO4. 分析 (1)氯化镁为离子化合物,必须标出阴阳离子的电子式;双氧水中两个氢原子分别与两个氧原子通过共用一对电子结合,两个氧原子之间通过共用1对电子结合;
(2)二氧化碳中碳原子与氧原子共用4对电子;
(3)元素最高正价与最低负极绝对值和为8,依据磷酸的分子式推测其最高正价进而求出最低负价;
(4)地壳中含量最高的金属元素为铝,铝原子有3个电子层,最外层有3个电子;
(5)氢氧化钠含有离子键和共价键,过氧化钠含有共价键和离子键;
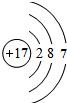
(6)原子序数为17的原子核外有3个电子层,各层容纳电子数分别为2、8、7,最高正价为+7价.
解答 解:(1)氯化镁为离子化合物,化学式中存在阴阳离子,其电子式中需要标出阴阳离子所带电荷,氯化镁的电子式为: ,双氧水为共价化合物,分子中存在两个氧氢键和一个O-O键,双氧水的电子式为:
,双氧水为共价化合物,分子中存在两个氧氢键和一个O-O键,双氧水的电子式为: ,故答案为:
,故答案为: ;
; ;
;
(2)二氧化碳中碳原子与氧原子共用4对电子,结构式为:O=C=O,故答案为:O=C=O;
(3)由磷元素的最高价氧化物的水化物化学式是H3PO4,可知P的最高正价为+5价,所以其最低负极为-3价,故答案为:-3价;
(4)地壳中含量最高的金属元素为铝,铝原子有3个电子层,最外层有3个电子,在周期表中位于第三周期第ⅢA族,故答案为:第三周期第ⅢA族;
(5)氢氧化钠、过氧化钠都含有离子键和共价键;
故答案为:离子键和共价键;
(6)原子序数为17的原子核外有3个电子层,各层容纳电子数分别为2、8、7,原子结构示意图, ;最高正价为+7价,最高价氧化物对应的水化物的化学式为:HClO4,故答案为:
;最高正价为+7价,最高价氧化物对应的水化物的化学式为:HClO4,故答案为: ;HClO4.
;HClO4.
点评 本题考查了电子式的书写,题目难度不大,注意掌握电子式的概念及书写原则,明确离子化合物与共价化合物的电子式表示方法及区别.


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 用物质A表示的反应的平均速率为 0.6 mol•L-1•s-1 | |
| B. | 用物质B表示的反应的平均速率为 0.6 mol•L-1•s-1 | |
| C. | 2 s 时物质A的转化率为70% | |
| D. | 2 s 时物质B的浓度为 0.7 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=5的H2S溶液中:c(H+)=c(HS-)=1×10-5mol•L-1 | |
| B. | 将0.01 mo1•L-1的盐酸与0.01 mo1•L-1氨水等体积混合:c(NH4+)=c(Cl-) | |
| C. | 在Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+c(H2CO3) | |
| D. | 在0.1 mo1•L-1CH3COONa溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(CH3COOH)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
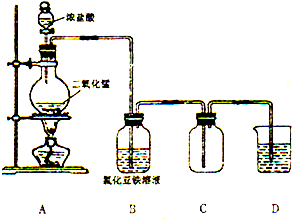 某化学研究型学习小组利用以下装置制取并探究氯气的性质.【装置A中发生反应的化学方程式:MnO2+4HCl(浓)═MnCl2+Cl2↑+2H2O】
某化学研究型学习小组利用以下装置制取并探究氯气的性质.【装置A中发生反应的化学方程式:MnO2+4HCl(浓)═MnCl2+Cl2↑+2H2O】查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 磷(P)基态原子最外层轨道表示式: | |
| B. | 钢铁发生吸氧腐蚀的正极反应式: O2+4H++4e-═2H2O | |
| C. | 葡萄糖的实验式:C6H12O6 | |
| D. | 氰基的电子式: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量浓度相等的①NH4C1、②(NH4)2S04、③NH4HS04溶液中,c(NH4+)的大小顺序:②>③>① | |
| B. | 0.2 mol•L-1CH3COOH溶液和0.2 mol•L-1CH3COONa溶液等体积混合:c(CH3COO-)+c(OH-)-c(H+)=0.1 mol•L-1 | |
| C. | pH=2的H2SO3溶液与pH=12的NaOH溶液等体积混合:c(HSO3-)>c(Na+)>c(H+)>c(OH-) | |
| D. | 0.1 mol•L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(OH-)>c(CO32-)>c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钠可用作食品添加剂 | B. | 过氧化钠可用作潜水艇供氧剂 | ||
| C. | 铝制容器可以贮运稀硝酸 | D. | 氧化铁可用作外墙涂料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CS2、SO3、P4和C6H6都是非极性分子 | |
| B. | 在H3O+和[Cu(H2O)4]2+中都存在配位键 | |
| C. | 元素电负性越大的原子,该元素的原子吸引键合电子的能力越强 | |
| D. | 在电中性晶体中只要含有阳离子,则一定含有阴离子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com